Una ventina i morti finora segnalati (ma poi è calata la coltre del silenzio e non è dato sapere se le segnalazioni di eventi avversi gravi o morti sono continuate) dopo il vaccino antinfluenzale. Ministero e Iss
ancor prima di avere sottomano le relazioni delle autopsie, ma ora emerge un altro inghippo: il vaccino sul mercato quest’anno non ha azzeccato le previsioni sui virus influenzali circolanti e quindi non copre, se non in minima parte, da ciò cui siamo realmente esposti.
preferiscano ignorare questa segnalazione. I cittadini italiani sono quindi svantaggiati perché hanno meno informazioni e quindi non saranno veramente liberi di fare una scelta informata.La notizi ha causato polemiche e preoccupazione negli Stati Uniti. Il ceppo predominante in circolazione al momento negli Usa è una forma mutata del virus H3N2: più della metà dei campioni influenzali tratti da persone malate ha mostrato di non essere un buon ‘match’ per il vaccino.Eppure i responsabili della salute pubblica Usa continuano a invitare la popolazione a vaccinarsi, «in quanto – dicono – il vaccino puo’ fornire teoricamente ‘protezione incrociata’, ossia diminuire la durata della malattia».

2014-2015 Influenza Stagione Settimana 48 termina 29 nov 2014
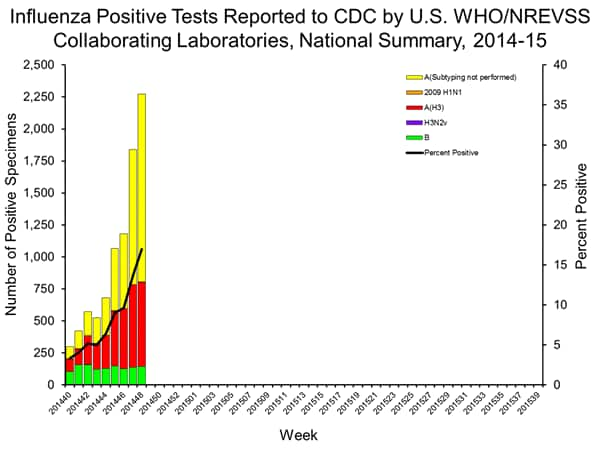
Durante la settimana 48 (23-29 Novembre 2014), l’attività influenzale è aumentata negli Stati Uniti.
Sorveglianza virale: di 13.398 campioni analizzati e riportati da US Organizzazione Mondiale della Sanità (OMS) e National respiratorie e Enteric virus Sistema di Sorveglianza (NREVSS) collaborando laboratori durante la settimana 48, 2274 (17,0%) sono risultati positivi per l’influenza.
Polmonite e influenza Mortalità: La percentuale di decessi attribuiti a polmonite e influenza (P & I) è stato al di sotto della soglia epidemica.
Influenza associata a morti pediatriche: Non sono stati riportati decessi pediatrici-influenzali associati.
: Influenza associata a ricoveri è stato riportato un tasso cumulativo per la stagione di 1,8 ricoveri influenzali associati confermati in laboratorio per 100.000 abitanti.
Ambulatorio Malattia Sorveglianza: La percentuale di visite ambulatoriali per la malattia simil-influenzale (ILI) è stato del 2,6%, al di sopra della linea di base nazionale del 2,0%. Otto dei 10 regioni riferito ILI a livelli basali regionali specifici. Puerto Rico e sei stati sperimentati alta attività ILI; uno stato sperimentato attività ILI moderata; cinque stati sperimentati bassa attività ILI; New York City e 38 stati sperimentati minima attività ILI; e il Distretto di Columbia aveva dati sufficienti.
Diffusione geografica di Influenza: La diffusione geografica di influenza in Puerto Rico e sei stati è stato segnalato come diffusa; 14 stati segnalati attività regionali; Isole Vergini Americane e 19 stati segnalati attività locali;il Distretto di Columbia e 11 stati segnalati attività sporadica; e Guam non ha segnalato.
Sintesi Nazionale e Regionale di Selezione dei componenti di sorveglianza
| HHS Sorveglianza Regioni * |
Cumulato dei dati dal 28 Settembre 2014 (Settimana 40) |
| Out-paziente † ILI |
Numero di giurisdizioni segnalazione activity§ regionale o diffusa |
% campioni respiratori positivi per l’influenza ‡ |
A (H1N1) pdm09 |
A (H3) |
A (Subtyping non eseguito) |
B |
Morti pediatrici |
| Nazione |
Elevato |
21 di 54 |
17,0% |
33 |
3.093 |
4.502 |
1.234 |
5 |
| Regione 1 |
Elevato |
3 di 6 |
2,3% |
1 |
36 |
24 |
15 |
0 |
| Regione 2 |
Elevato |
1 di 4 |
1,7% |
6 |
114 |
33 |
29 |
0 |
| Regione 3 |
Elevato |
1 di 6 |
8,5% |
1 |
223 |
131 |
44 |
0 |
| Regione 4 |
Elevato |
6 di 8 |
14,1% |
2 |
484 |
2.039 |
646 |
4 |
| Region 5 |
Elevato |
4 di 6 |
19,8% |
9 |
473 |
831 |
66 |
0 |
| Regione 6 |
Elevato |
3 su 5 |
22,7% |
4 |
569 |
1.116 |
296 |
0 |
| Regione 7 |
Elevato |
0 di 4 |
10,0% |
2 |
203 |
63 |
42 |
0 |
| Regione 8 |
Normale |
2 di 6 |
11,2% |
3 |
233 |
131 |
27 |
0 |
| Regione 9 |
Normale |
0 su 5 |
3,0% |
4 |
164 |
66 |
51 |
1 |
| Regione 10 |
Elevato |
1 di 4 |
18,4% |
1 |
594 |
68 |
18 |
0 |
|
Week 48 |
| Numero di campioni testati |
13.398 |
| Numero di campioni positivi (%) |
2.274 (17,0%) |
| I campioni positivi per tipo / sottotipo |
|
| Influenza A |
2.129 (93,6%) |
| A (H1N1) pdm09 |
5 (0,2%) |
| H3 |
656 (30,8%) |
| Subytping non eseguita |
1.468 (69,0%) |
| Influenza B |
145 (6,4%) |
Vista LIVELLO Nazionale e Regionale Grafici e dati | Vedere la tabella dei dati |
Influenza Virus Caratterizzazione *:
CDC ha caratterizzato 132 virus influenzali [1 A (H1N1) pdm09, 114 A (H3N2), e 17 virus dell’influenza B] da noi raccolti laboratori dal 1 ottobre 2014.
Influenza A virus [115]
A (H1N1) pdm09 [1]: L’unico virus H1N1 testato è stato caratterizzato come A / California / 7/2009 del-like, la componente influenza A (H1N1) del vaccino influenzale 2014-2015 nell’emisfero settentrionale.
A (H3N2) [114]: Forty-otto (42%) dei 114 virus H3N2 testati sono stati caratterizzati da A / Texas / 50/2012-like, la componente di influenza A (H3N2) dell’influenza 2014-2015 nell’emisfero settentrionale vaccino. Sixty-sei (58%) dei 114 virus testati hanno mostrato sia titoli ridotti con antisiero prodotto contro A / Texas / 50/2012 o apparteneva a un gruppo genetico che mostra tipicamente titoli ridotte a A / Texas / 50/2012. Tra i virus che hanno mostrato titoli con antisiero contro A / Texas / ridotti 50/2012, la maggior parte erano antigenicamente simili al A / Svizzera / 9715293/2013, il virus H3N2 selezionato per il vaccino contro l’influenza dell’emisfero australe il 2015. A / Svizzera / 9715293/2013 è legata a, ma antigenicamente e geneticamente distinguibili, dalla A / Texas / 50/2012 virus vaccinale.A / Svizzera-come virus H3N2 sono stati rilevati negli Stati Uniti in piccole quantità nel marzo del 2014 e ha cominciato ad aumentare attraverso la primavera e l’estate.
Influenza B virus [17]
Ten (58,8%) dei virus dell’influenza B testati appartengono a B / Yamagata / 16/88 lignaggio e le restanti sette virus (41,2%) l’influenza B testati appartengono a B / Victoria / 02/87 lignaggio.
Yamagata Lineage [10]: Tutti i virus dieci B / Yamagata-lignaggio sono stati caratterizzati da B / Massachusetts / 2/2012-simile, che è incluso come componente di influenza B del 2014-2015 nell’emisfero settentrionale trivalenti e quadrivalente influenzali vaccini.
Victoria Lineage [7]: Tutti i virus sette B / Victoria-lignaggio sono stati caratterizzati da B / Brisbane / 60/2008-like, il virus che è incluso come componente di influenza B del dell’emisfero settentrionale vaccino quadrivalente influenzale 2014-2015.
* CDC utilizza abitualmente l’inibizione emoagglutinazione (HI) per confrontare quanto i virus influenzali attualmente in circolazione siano quelli inclusi nel vaccino influenzale, e di monitorare per i cambiamenti nel virus influenzali circolanti. Tuttavia, una parte della recente influenza A (H3N2) non crescono di titoli emoagglutinazione sufficienti per la caratterizzazione antigenica da HI. Per molti di questi virus, CDC è anche eseguendo la caratterizzazione genetica di dedurre le proprietà antigeniche.
Antivirale Resistance:
Prove di influenza A (H1N1) pdm09, A (H3N2) e il virus dell’influenza B, isolati per la resistenza agli inibitori della neuraminidasi (oseltamivir e zanamivir) viene eseguita dal CDC usando un test funzionale. Ulteriori A (H1N1) pdm09 e A (H3N2) campioni clinici sono testati per mutazioni del virus noto per conferire resistenza all’oseltamivir. I dati riassunti sotto combinare i risultati di entrambi i metodi di prova. Questi campioni sono regolarmente ottenuti per scopi di sorveglianza, piuttosto che per i test diagnostici dei pazienti sospettati di essere infetti dal virus antivirali resistente.
Alti livelli di resistenza agli adamantani (amantadina e la rimantadina) persistono tra A (H1N1) pdm09 e A (H3N2) virus (i adamantani non sono efficaci contro i virus dell’influenza B). Pertanto, i dati di test di resistenza adamantano non sono presentati qui di seguito.
Neuraminidasi Inhibitor Resistenza Test Risultati su campioni prelevati dal 1 Ottobre 2014
|
Oseltamivir |
Zanamivir |
| Campioni di virus testati (n) |
Virus resistenti, Numero (%) |
Campioni di virus testati (n) |
Virus resistenti, Numero (%) |
| Influenza A (H3N2) |
71 |
0 (0.0) |
71 |
0 (0.0) |
| Influenza B |
24 |
0 (0.0) |
24 |
0 (0.0) |
| A (H1N1) pdm09 |
5 |
0 (0.0) |
5 |
0 (0.0) |
Negli Stati Uniti, tutti i virus influenzali circolanti recentemente sono stati sensibili all’ inibitore della neuraminidasi antivirale farmaci, oseltamivir e zanamivir; tuttavia, rari casi sporadici di oseltamivir-resistente A (H1N1) pdm09 e A (H3N2) virus sono stati rilevati in tutto il mondo. Trattamento antivirale con oseltamivir o zanamivir è raccomandato il più presto possibile per i pazienti con influenza confermata o sospetta che hanno malattie gravi, complicate, o progressivo;che richiedono il ricovero in ospedale; o che sono ad alto rischio di gravi complicanze da influenza.
Ulteriori informazioni sulle raccomandazioni per il trattamento e la chemioprofilassi di infezione da virus influenzale con agenti antivirali è disponibile presso http://www.cdc.gov/flu/antivirals/index.htm .
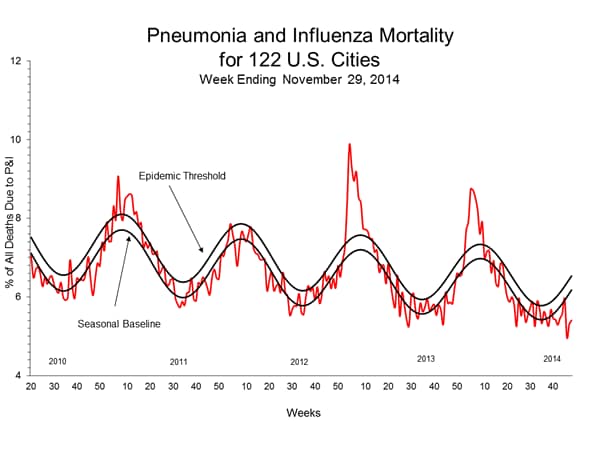
Polmonite e influenza (P & I) Mortalità Sorveglianza:
Durante la settimana 48, il 5,4% di tutti i decessi segnalati attraverso il 122 Cities mortalità Reporting System erano dovuti alla P & I. Questa percentuale era inferiore alla soglia epidemica del 6,5% per 48 settimane.
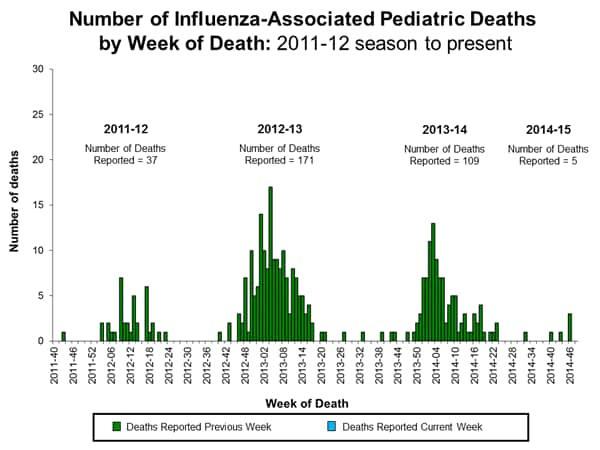
Influenza associata alla mortalità pediatrica:
. Nessun decesso pediatrico influenzale, è stato segnalato alla CDC durante la settimana 48. Ad oggi, cinque morti pediatriche influenzali associate, sono state segnalate per la stagione 2014-2015
Ulteriori dati sono disponibili all’indirizzo:
http://gis.cdc.gov/ GRASP / Fluview / PedFluDeath.html .
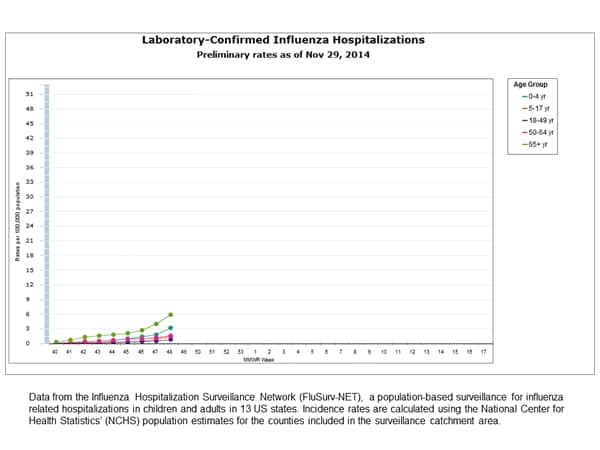
Influenza Associata a Ricoveri:
L’ospedalizzazione rete di sorveglianza dell’influenza (FluSurv-NET) conduce la sorveglianza sulla popolazione per ricoveri da influenza confermati in laboratorio nei bambini di età inferiore ai 18 anni (dal momento che la stagione 2003-2004 l’influenza) e adulti (a partire dalla stagione 2005-2006 l’influenza ).
Il FluSurv-NET copre più di 70 contee nelle 10 Emerging Infections Programma (EIP) stati (CA, CO, CT, GA, MD, MN, NM, NY, OR, e TN) e ulteriore Influenza ospedalizzazione progetto di sorveglianza (IHSP) Stati. Il IHSP iniziata durante la stagione 2009-2010 per migliorare la sorveglianza durante il 2009 H1N1 pandemica. Siti IHSP inclusi IA, ID, MI, OK e SD durante la stagione 2009-2010; ID, MI, OH, OK, RI, e UT durante la stagione 2010-2011; MI, OH, RI, e UT durante la stagione 2011-2012; IA, MI, OH, RI, e UT durante la stagione 2012-2013; e MI, OH, e UT durante il 2013-2014 e 2014-15 stagioni.
I dati raccolti sono utilizzati per stimare i tassi di ospedalizzazione specifici per età su base settimanale, e descrivere le caratteristiche delle persone ricoverate con grave malattia influenzale. Le tariffe previste sono suscettibili di essere una sottostima come ricoveri da influenza possono perdere, sia perché il test non viene eseguito, o perché i casi possono essere attribuiti ad altre cause di polmonite o altre complicazioni da influenza comuni.
Tra il 1 ottobre 2014 e 29 Novembre 2014, sono stati segnalati 500 ricoveri influenzali associati confermati in laboratorio. Il tasso complessivo di ospedalizzazione era 1,8 per 100.000 abitanti. Il più alto tasso di ospedalizzazione è stato tra gli adulti di età compresa tra ≥65 anni (5,9 per 100.000 abitanti). Tra tutti i ricoveri, 444 (88,8%) sono stati associati con l’influenza A, 51 (10,2%), con l’influenza B, 3 (0.6%) con il virus dell’influenza A e B co-infezione, e 2 (0,4%) non ha avuto informazioni sul tipo di virus. Tra quelli con influenza A sottotipo informazioni, 116 (100%) erano virus H3N2.
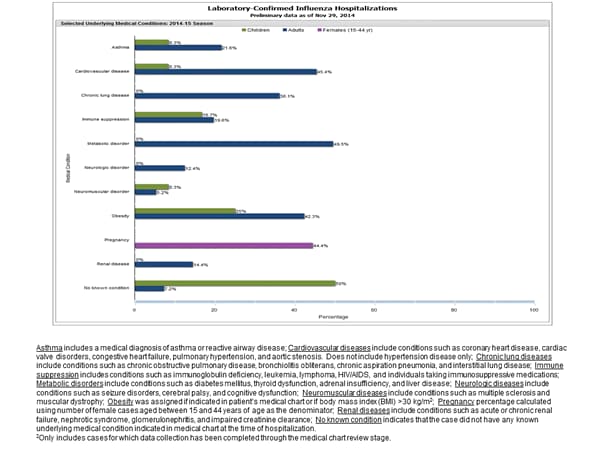
I risultati clinici sono preliminari e basati su 109 casi (22%) pediatrici e adulti con completa astrazione cartella clinica. La maggioranza (93%) degli adulti ospedalizzati ha avuto almeno un riportato condizione medica di base; il più comunemente riportati sono stati disordini metabolici, malattie cardiovascolari e l’obesità. Sette (7%) adulti ospedalizzati non avevano identificato condizioni mediche di base. Tra i 12 bambini ricoverati in completa medico grafico astrazione, 6 (50%) non avevano condizioni mediche di base identificati. Tra le nove donne ricoverate in età fertile (15-44 anni), quattro erano in stato di gravidanza.
Dati FluSurv-NET aggiuntive si possono trovare at:
http://gis.cdc.gov/GRASP/Fluview/FluHospRates.html
http://gis.cdc.gov/grasp/fluview/FluHospChars.html
Ambulatorio Malattia di sorveglianza:
Nationwide durante la settimana 48, il 2,6% delle visite di pazienti segnalati attraverso gli Stati Uniti ambulatoriale malattia simil-influenzale Network Surveillance (ILINet) erano dovute a malattia simil-influenzale (ILI). Questa percentuale è al di sopra della soglia nazionale di 2,0%.
(ILI è definita come la febbre (temperatura di 100 ° C [37,8 ° C] o superiore) e la tosse e / o mal di gola).
Sono disponibili dati aggiuntivi
http://gis.cdc.gov/grasp/fluview/fluportaldashboard.html
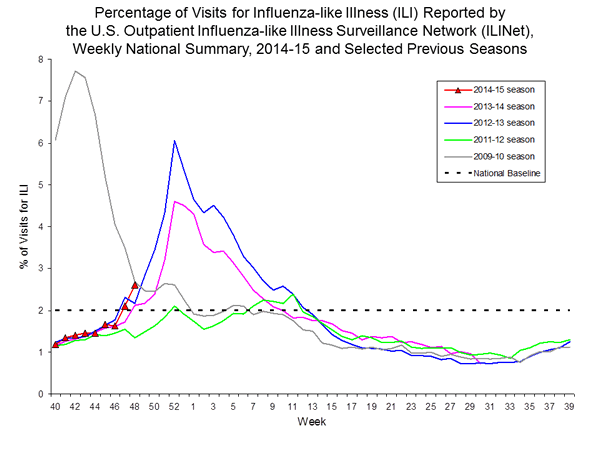
A livello regionale, la percentuale di visite ambulatoriali per ILI variava dal 1,0% al 4,5% durante la settimana 48. Otto regioni (regioni 1, 2, 3, 4, 5, 6, 7, e 10), ha registrato una percentuale di visite ambulatoriali per ILI pari o superiore ai livelli di base specifici per la regione.
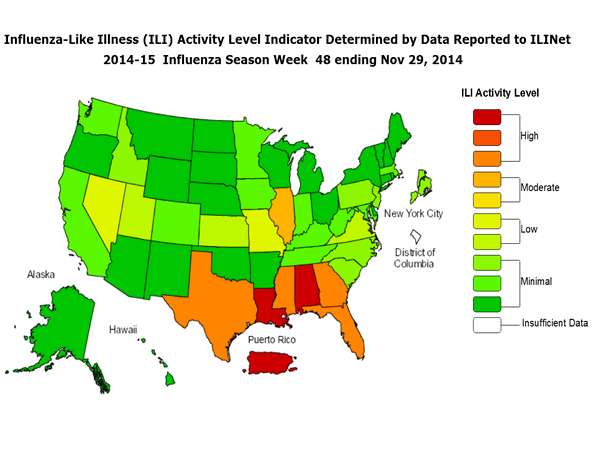
Indicatore di attività ILINet State Map:
I dati raccolti in ILINet vengono utilizzati per produrre una misura di attività ILI * per stato. I livelli di attività sono basate sulla percentuale di visite ambulatoriali in uno stato a causa di ILI e sono confrontati con la percentuale media di visite ILI che si verificano durante le settimane con poco o nessun virus dell’influenza circolazione. I livelli di attività spaziano dal minimale, che corrisponderebbe ad attività ILI da ambulatori di essere seguito, o solo leggermente al di sopra, la media, per elevata, che corrisponde all’attività ILI da ambulatori di essere molto superiore alla media.
Durante la settimana 48, i seguenti livelli di attività ILI sono stati riportati:
Puerto Rico e sei stati (Alabama, Florida, Georgia, Louisiana, Mississippi e Texas) sperimentato alta attività ILI.
Uno Stato (Illinois) con esperienza di attività ILI moderata.
Cinque Stati (Kansas, Missouri, Nevada, Utah e Virginia) hanno sperimentato una bassa attività ILI.
New York City e 38 stati (Alaska, Arizona, Arkansas, California, Colorado, Connecticut, Delaware, Hawaii, Idaho, Indiana, Iowa, Kentucky, Maine, Maryland, Massachusetts, Michigan, Minnesota, Montana, Nebraska, New Hampshire, New Jersey , New Mexico, New York, North Carolina, North Dakota, Ohio, Oklahoma, Oregon, Pennsylvania, Rhode Island, South Carolina, South Dakota, Tennessee, Vermont, Washington, West Virginia, Wisconsin, e Wyoming) sperimentato minima attività ILI.
I dati non sono sufficienti per calcolare un livello di attività ILI dal District of Columbia.
Diffusione geografica di influenza come valutato dagli epidemiologi
L’attività influenzale riportata da epidemiologi statali e territoriali indica la diffusione geografica del virus dell’influenza, ma non misura la gravità dell’attività influenzale.
Durante la settimana 48, la seguente attività influenzale è stato segnalato:
Attività di influenza diffusa è stata riportata da Puerto Rico e sei stati (Alaska, Florida, Illinois, Louisiana, Maryland e North Carolina).
Attività di influenza regionale è stato riportato da 14 stati (Alabama, Colorado, Georgia, Indiana, Kentucky, Maine, Massachusetts, Minnesota, Mississippi, New Hampshire, Oklahoma, Texas, Utah, e Wisconsin).
Attività di influenza locale è stato segnalato da Isole Vergini Americane e 19 stati (Arkansas, Connecticut, Delaware, Iowa, Kansas, Michigan, Missouri, Montana, Nebraska, Nevada, New Jersey, New York, Ohio, Oregon, Pennsylvania, South Carolina, Vermont , Virginia, e Wyoming).
Attività di influenza sporadica è stata riportata dal Distretto di Columbia e 11 Stati (Arizona, California, Hawaii, Idaho, New Mexico, North Dakota, Rhode Island, South Dakota, Tennessee, Washington e West Virginia).
Guam non ha riportato.
FluView Presenta applicazioni interattive in grado di fornire immagini dinamiche dei dati influenzali raccolti e analizzati da CDC. Queste applicazioni interattive FluView permettono alle persone di creare su misura, interpretazioni visive di dati influenzali, così come fanno i confronti tra le stagioni influenzali, regioni, gruppi di età e una varietà di altri dati demografici.
http://ecdc.europa.eu/en/publications/surveillance_reports/influenza/Pages/weekly_influenza_surveillance_overview.aspx
È stata una reazione correlata al vaccino, o la risposta immunitaria al virus in sé?