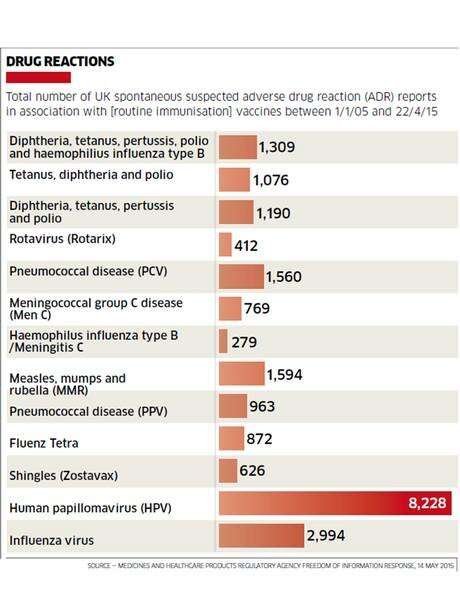
I ritiri avevano riguardato alcuni lotti, nessun lotto fu ritirato in Italia.
I lotti interessati :
http://www.sukl.sk/buxus/docs/Inspekcia/PostregistracnaKontrola/Mimoriadne_oznamy/Rozhodnutie_Infanrix121007.pdf
Articoli:
http://www.sukl.sk/
http://www.ta3.com/embed/FC6F1ED8-9A66-4339-BE56-2A1337FEB196.html
http://www.sukl.sk/sk/bezpecnost-liekov/bezpecnostne-opatrenia-a-upozornenia/statny-ustav-nariadil-stiahnutie-jednej-sarze-vakciny-infanrix-hexa-pacienti-ohrozeni-nie-su?page_id=3170
http://www.pluska.sk/spravy/z-domova/na-stahovanu-vakcinu-infanrix-hexa-zaznamenali-14-hlaseni-neziaduce-ucinky.html?forward=sk_mobil_clanok.jsp
In questo articolo viene riportato che sono stati ritirati complessivamente 1113 pacchetti da dieci unità. Così in totale circa 11.130 vaccini.
http://www.teraz.sk/zahranicie/z-ceskeho-trhu-stiahli-vakcinu-aby-n/24767-clanok.html
http://www.slobodavockovani.sk/news/podozrivou-vakcinou-ockuju-uz-rok-dostalo-ju-aj-vase-dieta-/
http://www.slobodavockovani.sk/news/nezodpovedane-otazky-okolo-infanrixu-hexa-a-stiahnutia-jednej-sarze/
http://www.slobodavockovani.sk/news/sukl-statny-ustav-pre-kontaminaciu-lieciv/
-
11.10.2012 AUSTRALIA – N. 6 LOTTI
A21CB144A Scadenza 31 January 2014
A21CB188D Scadenza 31 January 2014
A21CB188E Scadenza 31 January 2014
A21CB190A Scadenza 31 January 2014
A21CB197A Scadenza 31 January 2014
A21CB221B Scadenza31January2014
Documento Ufficiale
http://www.tga.gov.au/safety/alerts-medicine-infanrix-121011.htm#.UHiSXLvFgPM.facebook
- 12.10.2012 GERMANIA – N. 10 LOTTI
A21CB191C,
A21CB193A,
A21CB193B,
A21CB193C,
A21CB194A
E FORSE ALTRI 5 LOTTI: A21CB187B,A21CB337A,A21CB187C,A21CA742A,A20CA743A
Documento ufficiale
http://www.akdae.de/
in questo documento si evince lo stop immediato alle vaccinazionihttp://www.akdae.de/Arzneimittelsicherheit/Weitere/Archiv/2012/20121010.pdf
- 13.10.2012 FRANCIA
-
– AC20B199AC Sospensione iniettabile in muscolo Infrarix Tetra (Infrarix IPV e rosso) Scadenza: Gennaio 2014 Francuski numero di registrazione: 3400935524676
- Ottobre 2012 ritiro di lotti di vaccini Infanrix Hexa in 19 Paesi del Mondo, ad esclusione dell’Italia (l’esavalente attualmente utilizzata nel nostro Paese), per sospetta contaminazione di un batterio.
- A20CA742A A20CA743A –A20CA744B Infanrix Quinta (Infrarix IPV + HIB ndr rosso)polvere e sospensione per iniezione in un muscolo Scadenza:Gennaio2014 numero francese di registrazione: 3400935524737
- A21CB337A Infanrix Hexa, polvere e sospensione per iniezione in un muscoloScadenza:Gennaio2014
Numero di registrazione francese: 3400935495839
Documento Ufficiale
http://ansm.sante.fr/S-informer/Informations-de-securite-Retraits-de-lots-et-de-produits/Infanrix-Tetra-Quinta-Hexa-poudre-et-suspension-pour-suspension-injectable-en-seringue-preremplie-Laboratoire-GSK-Retrait-de-lots/(language)/fre-FR
Articolo
http://www.slobodavockovani.sk/news/aj-vo-francuzsku-stahuju-z-trhu-infanrix-hexa-a-navrch-k-tomu-aj-infanrix-polio-a-infanrix-ipv-hib/
- 08.10.2012 SPAGNA – N. 1 LOTTO A21CB187E –
Data di scadenza: 30/01/2014
Documento Ufficiale
http://www.aemps.gob.es/informa/alertas/medicamentosUsoHumano/2012/calidad_42-12.htm
pdfhttp://www.aemps.gob.es/informa/alertas/medicamentosUsoHumano/2012/docs/calidad_42-12.pdf
RITIRO ULTERIORE LOTTO IN SPAGNA y 12N0010 (Scad. 31/08/2013)
http://www.sefh.es/sefhboletin/vernoticiaboletin.php?id=5313
- 11.10.2012 – CANADA – N. 1 LOTTO – A21CB242A
Nell’articolo vengono rassicurati i genitori che il ritiro è solo precauzionale e che dal mese di aprile 2012 sono stati vaccinati 20.000 bambini. Non ci sono state segnalazioni di problemi con questo vaccino che indicano la contaminazione batterica in BC o in 1,2 milioni di dosi distribuite in tutto il mondo.
http://www.bccdc.ca/imm-vac/VaccinesBC/infanrix.htm
- 08.10.2012 – OLANDA – N. 1 LOTTO – AC20B199AA
http://www.rivm.nl/Bibliotheek/Algemeen_Actueel/Veelgestelde_vragen/Infectieziekten/Rijksvaccinatieprogramma/Veelgestelde_vragen_recall_Infanrix_IPV
- 16.10.2012 – GRECIA – N. 2 LOTTI – A21CB187B & A21CB187C
Articoli
http://www.xanthi1.gr/?p=6379
http://www.xanthipress.gr/index.php/eidiseis/koinonia/18132-anaklhsh-partidwn-tou-farmakou-infanrix-hexa
Di seguito sono riportate ulteriori informazioni che hanno interessato il suddetto vaccino negli ultimi mesi.
- La vaccinazione esavalente contiene due vaccini non obbligatori. Infatti, i vaccini obbligatori in Italia sono solo Difterite, Tetano, Polio ed Epatite B. Il vaccino esavalente contiene anche:
anti-Haemophilus tipo b (Hib) coniugato e antipertossico (componenti acellulari) (Pa).
Il genitore che decide di vaccinare solo per i 4 obbligatori, di cui sopra, può esigere presso la propria A.S.L. solo la somministrazione di detti vaccini. Non sarà cosa semplice, perchè solitamente non li hanno disponibili.
http://torino.repubblica.it/cronaca/2014/06/15/news/vaccino_il_gip_ordina_nuove_indagini_sull_esavalente-89036764/?ref=fbpr
- Il Codacons nel giugno 2012 è intervenuto in merito allo spreco di soldi pubblici per vaccini pediatrici inutili, se non addirittura pericolosi.
http://www.codacons.it/articoli/sanita_la_corte_dei_conti_convoca_il_codacons_per_lo_scandalo_degli_sprechi_nei_vaccini__249824.html
http://www.senato.it/japp/bgt/showdoc/frame.jsp?tipodoc=Resaula&leg=16&id=00668529&part=doc_dc-allegatob_ab-sezionetit_icrdrs&parse=no
http://www.agenparl.it/articoli/news/politica/20121121-vaccini-codacons-consigli-balduzzi-sono-regalo-a-case-farmaceutiche
Attualmente il vaccino esavalente somministrato in Italia è l’Infanrix Hexa prodotto dalla GlaxoSmithKline S.p.A.. Con il presente file voglio riassumere diversi recenti fatti che hanno interessato questo vaccino.
BUGIARDINO (Foglietto illustrativo)
http://www.ema.europa.eu/docs/it_IT/document_library/EPAR_-_Product_Information/human/000296/WC500032505.pdf
Qual è il rischio associato a Infanrix Hexa? European Medicines Agency (EMA)
http://www.ema.europa.eu/docs/it_IT/document_library/EPAR_-_Summary_for_the_public/human/000296/WC500032499.pdf
- Notizie (di ottobre 2012) in merito ai ritiri di lotti di vaccini Infanrix Hexa (l’esavalente) in 19 paesi del mondo ad esclusione dell’Italia. *
https://www.facebook.com/groups/273779856034566/doc/371110262968191/
Qui il primo articolo redatto dal Dottor Roberto Gava in merito alle prime notizie relative ai suddetti ritiri
http://www.informasalus.it/it/articoli/vaccino-esavalente-ritirato.php
Successivamente era emerso che i ritiri erano avvenuti in ben 20 Paesi del Mondo ad esclusione dell’Italia.
http://www.ilfattoquotidiano.it/2012/10/16/rischio-contaminazione-vaccino-esavalente-ritirato-in-19-paesi-non-in-italia/384291/
http://www.ansa.it/web/notizie/specializzati/saluteebenessere/2012/10/17/Glaxo-ritira-lotti-esavalente-20-paesi_7644660.html
Molti hanno posto formali domande al nostro Ministero della Salute, ma o non hanno ottenuto risposte, oppure hanno ottenuto risposte poco esaustive.
“In seguito alla pubblicazione dell’articolo del Dr. Roberto Gava del 15.10.12 “Pericolo esavalente: vaccino ritirato” , l’Onorevole Elvira Savino ha richiesto interpellanza urgente (2/01724) al Ministro della Salute Renato Balduzzi. Pubblichiamo il resconto del dibattito dell’8 novembre tra l’Onorevole Elvira Savino ed il sottosegretario di Stato per la salute, Adelfio Elio Cardinale.”
http://www.informasalus.it/it/articoli/vaccino-resoconto-interpellanza.php
I ritiri avevano riguardato alcuni lotti, nessun lotto fu ritirato in Italia.
Nel file sono riportate le indicazioni dei lotti interessati
https://www.facebook.com/notes/autismo-danni-da-vaccinazioni-e-malasanita/infanrix-hexa-lotti-di-vaccino-ritirati/371110262968191
Non avendo ottenuto risposte in merito, la Fondazione Marco e Andrea Tremante, ha avviato anche una petizione a firma di Giorgio Tremante e del Prof. Giulio Tarro. La petizione è ancora in corso poiché non è stato ancora raggiunto il numero delle firme necessarie.
http://firmiamo.it/al-ministero-della-salute-chiarimenti-sul-ritiro-dei-vaccini/
Il chiarimento richiesto è in merito ai ritiri che hanno riguardato i 19 Paesi del Mondo per l’accertata presenza di un batterio contaminante nei lotti verificati. Le motivazioni della petizione riguardano la preoccupazione a causa del silenzio che il Ministero, ha mantenuto sulla vicenda, considerando soprattutto che il vaccino esavalente somministrato nel territorio italiano è anche lo stesso prodotto dalla multinazionale Glaxo Smith Kline. Inoltre i controlli vanno fatti nel luogo di produzione e non dopo l’immissione e/o la somministrazione. Di queste vicende nessuno dei media televisivi ha fatto menzione. Le giustificazioni fornite da alcuni lasciano il tempo che trovano….
Ci sono state anche interrogazioni parlamentari ma non sono state fornite risposte in merito.
(AGENPARL) – Roma, 15 nov – L’On. Borghezio, in un’interrogazione scritta indirizzata alla Commissione Europea, denuncia che: “una partita di vaccino esavalente -ovvero attivo contro sei malattie: difterite, tetano, epatite B, poliomielite, pertosse e haemophilus B- prodotto dalla Glaxo è risultato infettato dal ‘bacillus cereus’: il vaccino in questione, l’Infanrix Hexa, è somministrato ogni giorno in Europa a centinaia di bambini. Il vaccino, in seguito alla scoperta della contaminazione, è stato ritirato da ben 11 Paesi europei, ma non dall’Italia”.
Borghezio chiede quindi alla Commissione Europea: “la Commissione ha seguito la vicenda in modo approfondito, monitorando le azioni intraprese dalla Glaxo per verificare i lotti contagiati? Intende indagare sulla distribuzione del vaccino e sulla tutela intrapresa da ogni Stato membro per controllare i vaccini non ritirati?”.
http://www.agenparl.it/articoli/news/politica/20121115-vaccini-borghezio-lnp-ritirato-esavalente-in-11-paesi-ma-non-in-italia
Attualmente il maggior problema del vaccino esavalente è il contenuto di alluminio.Riporto il commento a questo articolo del Dott. Franco Aneddahttp://www.napolitime.it/2012/11/inchiesta-vaccini-il-progetto-gavi-i-soldi-la-disinformazione-i-tumori-e-altri-potenziali-danni/“…nell’Infanrix Hexa è presente sia come alluminio idrossido, idrato (Al(OH)3) 0,5 milligrammi, che come fosfato di alluminio (AlPO4) 0,32 milligrammi Al.”In tutto sono 0,82 mg di alluminio che vengono iniettati, con la prima dose, in un cucciolo umano di 70 giorni e del peso di 5-6 chili.
In pratica è una intossicazione acuta.
La somministrazione di paracetamolo peggiora ulteriormente la situazione in quanto, impegnando il fegato, rallenta la clearance dell’alluminio.”
- L’otto dicembre 2012, proprio nel nostro gruppo sono pervenute notizie dalla Francia da parte di Beatrice Dupont, la mamma di Stacy la bimba deceduta nel novembre 2011 a seguito di vaccinazioni multiplehttp://vactruth.com/2012/01/19/baby-dies-after-first-shots/ Era stato reso noto il contenuto di un corposo documento di 1.271 pagine riguardanti il vaccino Infanrix Hexa, prodotto dalla società farmaceutica GlaxoSmithKline. Il documento rivela un lungo repertorio di complicanze dove la società GSK ha la presunzione di affermare che gli eventi sono considerati seri solo se corrispondono ai criteri medici stabiliti da se stessa. Si contano 1.742 reazioni avverse, elencate in 41 paesi, inclusa l’Italia che detiene il primato con 595 segnalazioni: un record se si considera il fenomeno dell’under-reporting in Pediatria.* https://www.facebook.com/groups/273779856034566/permalink/392386407507243/?comment_id=432856180126932&offset=0&total_comments=18
Vengono riportati gli articoli relativi alla suddetta vicenda
10.12.2012 Vaccino Infanrix Hexa: documento rivela una sequela di complicanze
http://www.informasalus.it/it/articoli/infanrix-hexa-complicanze.php?fb_comment_id=fbc_412635715472130_72201324_412637638805271#f11a3b1b77fc9d6
11.12.2012 Infanrix Hexa: il parere della Pediatra in merito al report GSK
http://www.informasalus.it/it/articoli/infanrix-hexa-pediatra.php
Spesso ai nostri bambini la vaccinazione esavalente viene associata al vaccino pneumococco (a volte i genitori non vengono neanche informati prima dell’inoculazione) o addirittura anche il vaccino M.P.R.
http://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/ucm124514.pdf
TRADUZIONE http://translate.google.com/translate?hl=en&sl=auto&tl=it&u=http%3A%2F%2Fwww.fda.gov%2Fdownloads%2FBiologicsBloodVaccines%2FVaccines%2FApprovedProducts%2Fucm124514.pdf
Anche il Prof. Giulio Tarro infettivologo nell’inchiesta su Repubblica del novembre 2012 si è espresso in merito alle vaccinazioni multiple
http://inchieste.repubblica.it/it/repubblica/rep-it/2012/11/24/news/vaccini_il_prof_tarro_attenti_ai_deficit_immunologici_no_all_esavalente_e_al_trivalente_nello_stesso_giorno-47297510/
Qui un’altra testimonianza del Prof. Tarro Presidente della Commissione sulle Biotecnologie della Virosfera UNESCO,
http://www.informarexresistere.fr/2013/01/10/vaccini-pericolosi-rotto-un-muro-di-omerta-ecco-la-testimonianza-di-un-virologo-di-fama-mondiale/#axzz2OPZb9xz0
Nel file del gruppo “Studi Scientifici”https://www.facebook.com/groups/273779856034566/doc/436770456402171/ sono stati riportati diversi studi. In particolare, per questo vaccino, uno studio indipendente di ricercatori australiani ha confermato la presenza di tracce di mercurio nella quantità di 10 ppb nel vaccino Infanrix Hexa, studi relativi all’incidenza di casi di S.I.D.S. dopo la prima somministrazione di vaccino esavalente e studi relativi alla provata tossicità degli adiuvanti presenti nei vaccini.
- Eccipienti Ultimo aggiornamento febbraio 2012
http://www.cdc.gov/vaccines/pubs/pinkbook/downloads/appendices/B/excipient-table-2.pdf
- In data 22 Febbraio la Soc. Sanofi Pasteur MSD, la joint venture europea tra MSD e Sanofi Pasteur, ha annunciato che il Comitato per i prodotti medici di uso umano dell’Agenzia europea del farmaco ha raccomandato l’autorizzazione all’immissione in commercio del vaccino pediatrico esavalente Hexyon. Il nuovo vaccino esavalente sviluppato da Sanofi Pasteur sarà commercializzato in Europa occidentale con il marchio Hexyon.
http://www.pharmastar.it/index.html?cat=3&id=10443&frommailing=y&Email=s.narqqn%40gvfpnyv.vg&Password&newsid=2727
Pertanto anche in tali Paesi il vaccino Infanrix Hexa viene ancora utilizzato.
I nostri dubbi sono i seguenti:
– il vaccino viene prodotto negli stessi stabilimenti;
– nella normalità i controlli vengono eseguiti prima dell’immissione di qualsiasi prodotto.
- MENINGITE RITIRATI VACCINI PER NEONATI A CAUSA RISCHIO DI CONTAMINAZIONE
Meningitis vaccine for babies recalled over contamination fearsFONTE:
http://www.thetimes.co.uk/tto/health/article1883301.ece26 Febbraio 2009 Times On Line.
L’ente di controllo per il farmaco in Gran Bretagna (watchdog) ha autorizzato il ritiro di 21.000 dosi del vaccino Meningite C utilizzato per immunizzare i bambini a causa del rischio di contaminazione.
I farmaci comprendono una parte di 60.000 dosi singole ordinate dal Ministero della Sanità come parte di un programma di vaccinazione sulla Meningite C (MenC) per tutti i bambini compresi fra i e tre e quattro mesi di età .
“I lotti interessati del vaccino, che è venduto sotto il nome commerciale MENJUGATE, sono stati consegnati dal produttore, Novartis vaccini, nel mese di gennaio e febbraio. Finora 21.000 dosi sono stati inviati ai medici di base e cliniche.”
Il Dipartimento della Salute ha detto che non aveva ricevuto segnalazioni di reazioni avverse tra i bambini sottoposti al vaccino MenC , né ora né in passato.L’MHRA e Novartis hanno assicurato che il ritiro è puramente precauzionale e non vi è “alcuna prova che il vaccino sia contaminato o comporti un rischio per la salute.”
Quando i genitori portano i loro figli a vaccinarsi, è indispensabile che essi siano fiduciosi sul fatto che il vaccino è sicuro,” ha affermato Andrew Lansley, Segretario del Ministero Della Salute ( Sezione Shadow* cellula del governo preposta alle interrogazioni e dubbi inchieste etc..). “Mi auguro che i ministri provvederanno a fornire rassicurazione il più rapidamente possibile”.
Novartis, che produce il vaccino in Italia, ha detto di aver scoperto tracce di Staphylococcus aureus (…) nel solvente (inteso come soluzione) di ALLUMINIO IDROSSIDO, in cui il vaccino è sospeso, durante le prove eseguite su altri flaconcini , test fatti allo stesso tempo, ed inviati per via aerea alla Gran Bretagna, invece di seguire percorsi di spedizioni via terra, come erano soliti fare.
Il batterio Staphylococcus Aureus è associato con l’avvelenamento del sangue e infezioni della pelle.L’ufficio stampa di Novartis,a quanto si dice, è stato messo a conoscenza della questione il Lunedi. Tuttavia è stato il Martedì precedente che la società ha contattato L’Agenzia per la regolamentazione dei prodotti medicinali e sanitari (MHRA), ammettendo i problemi e dicendo che volevano ritirare il restante vaccino.
L’MHRA ha emesso un avviso di allerta farmaco alle farmacie alle 6:30 della scorsa notte, con più di 48 ore di ritardo.Un portavoce dell’MHRA ha dichiarato al Times Online che sembra che l’invio del vaccino all’interno della cabina pressurizzata potrebbe avere causato l’espansione del contenuto dei test in fialetta , consentendo all’agente contaminante di entrare.”Ulteriori indagini sulla la causa del fallimento sono in corso da parte della società. Attualmente non vi è alcuna prova per dimostrare che ci siano dei rischi per i bambini “, ha riferito l‘Ente per il controllo del farmaco (Watchdog).”I campioni testati che non hanno superato la prova della sterilizzazione facevano parte di uno studio non di routine, intrapreso dalla società e non rientravano nel mercato di prodotti del Regno Unito”.
Finora, si ritiene che circa un terzo dei 60.000 flaconcini siano stati distribuiti dai magazzini di stoccaggio agli ambulatori dei medici in tutto il paese.Non si sa quanti bambini sono stati finora vaccinati con dosi contaminate da questi lotti.Un portavoce del Dipartimento di Salute ha sottolineato che il ritiro è stato a scopo preventivo e che non era a conoscenza del fatto che alcun bambino avesse manifestato una reazione avversa al vaccino. “Adesso i due lotti britannici saranno sottoposti a ulteriori test per consentire il confronto e trarre conclusioni. I risultati saranno disponibili nel giro di pochi giorni “.
“Tutti i lotti di vaccino che sono entrati nel Regno Unito hanno superato tutte le prove, tra cui quelle della sterilizzazione “, ha detto un portavoce del Dipartimento della Salute.”Se le persone hanno ricevuto di recente questo vaccino e sono interessati, si rivolgano al proprio medico di famiglia o al di NHS Direct (Dipartimento della Salute)”.
Il Meningococco del gruppo C è un tipo di batterio che può causare la meningite e la setticemia. Il vaccino MenC non protegge contro la meningite causata da altri batteri o da virus.

Novartis è stato il principale fornitori di vaccini per il Dipartimento della Sanità della Gran Bretagna fin da quando è iniziato il programma di vaccinazione MenC nel 1999.Tutti i neonati viene somministrata una dose di vaccino MenC all’età di tre o quattro mesi.
A 12 mesi di età si sono sottoposti ad una combinazione di vaccino Hib (Haemophilus influenzae Tipo B) e MenC.Il Dipartimento della Salute ha detto di non essere a conoscenza di alcun precedente problema riguardo alla sicurezza del vaccino MenC.Novartis ha rilasciato una dichiarazione la scorsa notte dicendo: “stiamo collaborando con le autorità di governo, compresa la MHRA e il Ministero italiano della Salute, per ritirare i due lotti di Menjugate Kit distribuiti nel Regno Unito”.Ed ha proseguito: “Stiamo investigando su un test di sterilizzazione risultato positivo riguardo ad un lotto di solvente di IDROSSIDO DI ALLUMINIO che è stato utilizzato per l’imballaggio di due lotti di Menjugate“.”Il lotto riguardante il solvente ha superato tutte le specifiche di distribuzione, l’esemplare identificato è stato individuato nel corso di una ricerca particolare.”
Nessuna della società era disponibile questa mattina per l’approfondimento della dichiarazione.
COMMENTO:
Il vaccino Menjugate, prodotto in Italia dalla Novartis è utilizzato all’ASL n. 3 Umbria, come si può desumere da questa comunicazione ad opera del dipartimento di prevenzione della citata Asl Link:
intraweb.asl3.umbria.it/www/sitro/…/Meningite%20per%20medici.pd…

Il vaccino meningococcico coniugato , Menjugate , è costituito da un oligosaccaride del gruppo C meningococcico coniugato con la proteina Corynebacterium diphtheriae (l’agente che causa la difterite), CRM-197 (Cross Reacting Material).
Il vaccino meningococcico coniugato contro il sierotipo C di Neisseria meningitidis non protegge contro le infezioni meningococciche causate da altri tipi di batteri meningococcici (A, B, 29-E, H, I, K, L, W-135, X, Y, o Z, anche non tipizzati). Inoltre il vaccino non garantisce la protezione completa contro le infezioni causate dal sierogruppo meningococcico C.I vaccini coniugati contenenti la proteina Cross Reacting Material (CRM 197) non devono essere considerati come agenti immunizzanti contro la difterite.
Ai seguenti link trovate un lavoro del 19.04.2012 dell’avvocato Roberto Mastalia che ha condotto una vera e propria indagine in merito a questo vaccino che ha danneggiato il figlio.
- http://blog.libero.it/OrizzontiLontani/view.php?ssonc=80960120
BREVE STORIA DEL VACCINO MMR E DEL MORUPAR
a). 1990: Viene ritirato dal commercio in Canada il ceppo virale denominato URABE AM9 in quanto ritenuto responsabile di un numero di cd “reazioni avverse” superiore alla norma.
b). 1991: Nonostante quanto accaduto in Canada, l’italiana Biocine Sclavo (nel frattempo acquistata dalla Chiron e successivamente divenuta Novartis) inizia la commercializzazione del Vaccino trivalente MMR MORUPAR (antimorbillo, antipertosse, antirosolia) contenente il predetto principio attivo URABE AM9.
c). 1992: L’agenzia Europea del farmaco, su segnalazione del Ministero della Salute inglese, ritira dal commercio i vaccini trivalenti MMR PLUSERIX della Smith Kline & Beecham ed IMMRAVAX contenenti il medesimo principio attivo URABE AM9. Negli articoli della stampa italiana dell’epoca si evidenzia come altri due vaccini contenenti il medesimo principio attivo URABE AM9 – MMR MORUPAR prodotto da Biocine Sclavo (joint venture tra Istituto Sclavo e Chiron Corporation) e MPR TRIMOVAX prodotto dalla Merieux – per il momento non sarebbero stati ritirati ma sottoposti ad attenta osservazione e ad accertamenti per verificarne la dannosità.
d). 1993: Il Giappone decide dapprima il ritiro dal commercio e dalla somministrazione del vaccino MMR MORUPAR ritenuto, evidentemente, dannoso e quindi la sospensione di tutte le vaccinazioni MMR.
Nonostante ciò, il Ministero della Sanità italiano e l’AIFA non ritengono di avere sufficienti prove della dannosità del vaccino visto e considerato che non prendono alcun provvedimento. E’ probabile che il protrarsi di tale “negligenza” sia dovuto al fatto che, a partire dagli anni ’80 l’Istituto Sclavo era stato acquistato dall’ENI divenendo un punto di eccellenza dell’ENICHEM, all’epoca società a partecipazione statale, che forniva vaccini anche alle Forze Armate italiane.
Negli anni successivi il vaccino viene via via ritirato da altri paesi rimanendo commercializzato, tra i paesi maggiormente industrializzati, solo in Italia grazie al “colpevole silenzio” di chi doveva essere deputato al suo controllo. La scarsa farmacovigilanza dei paesi sudamericani ed asiatici, nei quali il vaccino continuava ad essere somministrato
e). 2004: nel mese di agosto il Brasile interrompe la somministrazione del vaccino MMR MORUPAR in seguito a quello che il giornalista del New York Times definisce “…un numero inaspettatamente alto di bambini che hanno ricevuto gravi reazioni allergiche in seguito ad un programma sperimentale di immunizzazione…”. Nell’articolo in questione il giornalista statunitense, al fine di tranquillizzare i propri lettori, sottolinea che il vaccino “…è venduto solo in Italia, Asia e Sud America, ma non negli Stati Uniti d’America…” .
E’ proprio in questo anno che, secondo quanto riportato dall’AIFA all’atto del successivo ritiro, iniziano a pervenire una serie di segnalazioni di “maggior allergenicità” del MMR MORUPAR rispetto ad altri vaccini omologhi.
f). 2005: nel mese di dicembre l’AIFA diffonde tra gli operatori sanitari un’informativa tesa ad aggiornare il profilo di sicurezza del vaccino MMR Morupar che, si ricorda, era già stato messo sotto osservazione nel 1992!
g). 2006: Finalmente, nel marzo 2006 l’AIFA comunica il “…divieto di vendita con ritiro dal mercato di Morupar…”. Al fine di mascherare le reali motivazioni che hanno portato al ritiro del prodotto e quindi le proprie gravissime responsabilità per l’innegabile negligenza dimostrata in 14 anni oltre che per prevenire la proliferazione delle cause di indennizzo e di risarcimento danni, l’AIFA giustifica tale provvedimento con “…una maggior frequenza di segnalazioni di reazioni allergiche con Morupar rispetto ad altri prodotti analoghi utilizzati in Italia.”. L’inconsistenza di tale motivazione appare palese a chiunque sia dotato di sufficiente raziocinio; se il vaccino non fosse stato riconosciuto palesemente più dannoso della norma non sarebbe stato certo ritirato (come accade tuttora per altri vaccini) col rischio di subire una causa da parte della casa farmaceutica!
h). 2010: Il 24 ottobre, come riportato dal Sunday Times, le autorità sanitarie inglesi sono costrette ad annunciare che il vaccino MMR avrebbe provocato il decesso di 40 bambini ed oltre 2.100 gravi danni tra i quali: due gravi danni cerebrali; 1.500 danni neurologici tra i quali 11 encefaliti e 13 casi di epilessia e coma. In realtà, tali dati corrisponderebbero solo al 10% dei casi.
Considerato che ogni anno in Italia nascono circa 550.000 bambini e che circa il 95% di questi viene vaccinato, ciò significa che in 14 anni circa 7 milioni di bambini (più i richiami) sono stati vaccinati con un prodotto che avrebbe potuto (e dovuto) essere bloccato sin dal 1992!
http://www.xapedia.it/medicina/vaccino-morbillo-parotite-rosolia/10729-il-vaccino-morupar-ritirato-dal-commercio

-
Ritirato vaccino influenzale Prefucel
http://www.saluteme.it/news/salute/2326-ritirato-vaccino-influenzale-prefucel.html

- Due vaccini ritirati in Giappone
http://it.euronews.com/2011/03/07/due-vaccini-ritirati-in-giappone/

http://youtube.googleapis.com/v/RJRHJlfbLOQ&fs=1&source=uds&autoplay=1
-
Divieto di utilizzo lotti di Menveo polvere per soluzione iniettabile
Il provvedimento è stato disposto, a seguito della segnalazione della ditta, concernente escursione dai limiti dei controlli in process durante il processo di fermentazione.18 APR – Si trasmette il provvedimento dell’AIFA concernente il divieto di utilizzo dei seguenti lotti del medicinale “MENVEO polvere per soluzione iniettabile”, della ditta Novartis Vaccines Srl:
M10094 scad. 02/2013;
M10105 scad. 01/2013;
M10141 scad. 02/2013;
M11039 scad. 08/2013.
http://www.ilfarmacistaonline.it/federazione/articolo.php?articolo_id=8475

Il vaccino esavalente Hexavac è stato ritirato nel 2005. Tra l’altro esiste una sentenza che condanna lo stato al risarcimento danni causati dal vaccino Hexavac! Nel 2004 il vaccino trivalente Priorix MPR ( ci risiamo con un vaccino combinato morbillo-parotite-rosolia) viene ritirato dal mercato. Il vaccino per il rotavirus ha una storia molto controversa, fra ritiri dal mercato e allarmismi vari resta uno dei più sospettosi.

- Vaccino acelluvax ritirato dal commercio con Decreto n. 800.F.1D/RM D3 del 29 marzo 1996
http://www.gazzettaufficiale.it/eli/id/1996/04/05/096A2216/sg
Qui un dossier redatto da un papà che ha un figlio danneggiato dal vaccino per la pertosse acelluvax, ritirato misteriosamente dal mercato senza una motivazione valida!
http://www.tuttosteopatia.it/wp-content/uploads/ce09296261ffee093daf04d53b36f532.pdf
E di mercurio non ne conteneva poco! 25 Mercurio (1)mcg/dose
http://www.report.rai.it/dl/Report/puntata/ContentItem-a8848ec1-06af-47db-bead-950842d7e1bd.html
http://www.salus.it/farmacopea/f2538.html

-
1992 Ritiro vaccino trivalente Pluserix parotite, morbillo e rosolia dell’ azienda produttrice: SMITH KLINE AND BEECHAM. sospetti di effetti collaterali per il ceppo virale ” Urabe Am9 ” , presente nel composto medico.
http://archiviostorico.corriere.it/1992/settembre/16/ritirato_vaccino_trivalente_insicuro_co_0_92091617405.shtml