Vaccini HPV : il Giappone ritira la raccomandazione, vince l’etica medica

Vaccini Hpv : Il Giappone per etica medica, non raccomanderà più la vaccinazione contro il papillomavirus (Gardasil- Cervarix). Si utilizza la scienza per proteggere gli interessi dell’industria farmaceutica e per negare la relazione causale tra il farmaco e le sue reazioni avverse
Traduzione e ricerca a cura di Vacciniinforma
PERCENTUALE DI VACCINAZIONE : SI PASSA DALL’80% A MENO DELL’1%. UN CASO? SICURAMENTE IL GOVERNO GIAPPONESE HA PRESTATO ATTENZIONE AI PROPRI CITTADINI E LI HA TUTELATI.
Ringraziamo i seguenti medici i quali ci hanno permesso di comprendere qual è stata l’esperienza medica giapponese relativa alla vaccinazione hpv:
Hirokuni Beppu, Masumi Minaguchi, Kiyoshi Uchide, Kunihiko Kumamoto, Masato Sekiguchi, Yukari Yaju
Il vaccino contro il papillomavirus umano (HPV) è stato associato ad una serie di gravi reazioni avverse. La gamma dei sintomi è varia, questi si sviluppano in tempi diversi. La sicurezza e l’efficacia del vaccino HPV trascura i seguenti punti:
- non viene presa in considerazione la base genetica del soggetto e/o predisposizione ad una malattia autoimmune;
- sicurezza e l’efficacia del vaccino;
- i meccanismi immunitari dell’HPV;
- Stimolazione antigenica eccessiva e prolungata nel tempo;
Tratteremo anche le questioni emerse nel corso dello sviluppo, promozione e distribuzione del vaccino, le insidie riscontrate nel monitoraggio degli eventi avversi e della verifica epidemiologica; e l’influenza delle grandi case farmaceutiche sulla politica e la ricerca sanitaria.
Introduzione
In questo documento, esaminiamo le reazioni avverse dopo la vaccinazione contro il papilloma virus (HPV) in Giappone e le misure adottate dal Ministero della Salute, del Lavoro e del Welfare (MHLW) ( 1 ) per ritirare la raccomandazione del vaccino. Queste misure hanno innescato polemiche nazionali e internazionali.
-
Panoramica del problema del vaccino HPV in Giappone
I vaccini HPV sono stati approvati successivamente in Giappone rispetto ai paesi occidentali (ottobre 2009 per Cervarix e luglio 2011 per Gardasil). Il tasso di vaccinazione era inizialmente basso. Tuttavia, dopo una campagna per la promozione del vaccino, che ha portato alla sovvenzione governativa del costo del vaccino nel novembre 2010, il tasso di vaccinazione è aumentato esponenzialmente e contemporaneamente anche l’ aumento imprevisto delle segnalazioni di eventi avversi, come MAI prima.
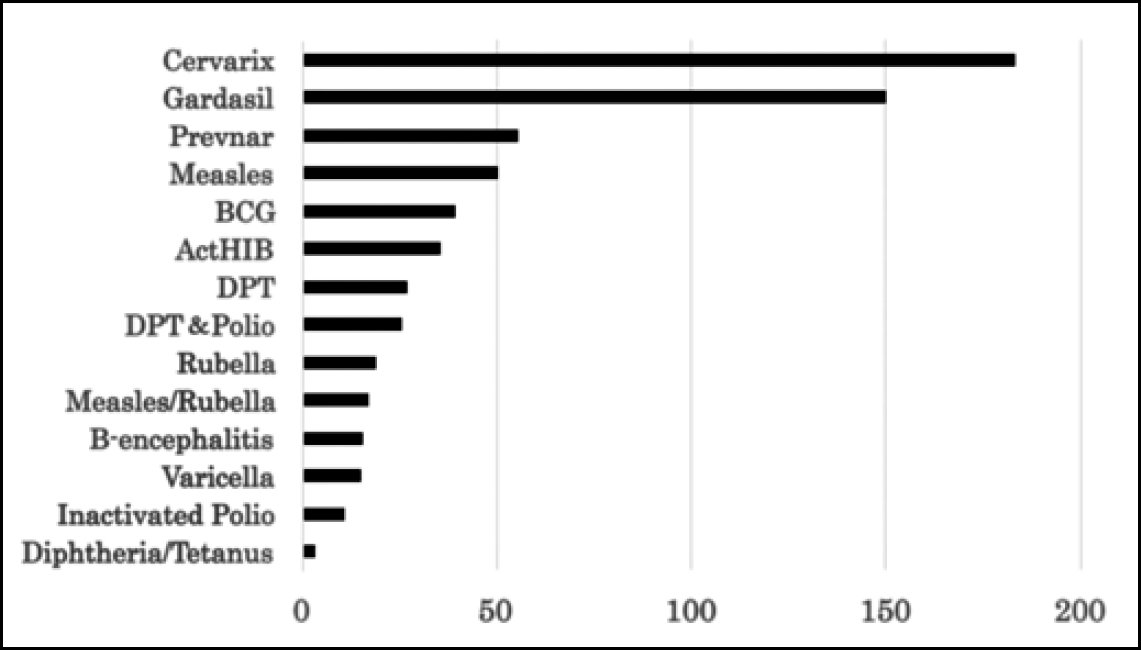
La tabella 1 mostra il numero di segnalazioni di eventi avversi gravi (ADR), definite secondo le linee guida ICH E2A ( 2 ), presentate in relazione ai vaccini HPV dai produttori alla fine di febbraio 2016 ( 3). Questi numeri superano di gran lunga quelli di altri vaccini, anche se si ammette la probabilità che la vigilanza sia più elevata per un vaccino di nuova introduzione rispetto a una più vecchi ( 4 , 5 ) . Poiché questi dati sono stati compilati da relazioni volontarie, l’incidenza effettiva di eventi avversi potrebbe essere molto più elevata ( 6 , 7 ).
Fig. 1
| Table 1: Reports of serious AEs/ADRs of HPV vaccines in Japan (3) | ||||
| Vaccines | Total dose* | Total number of inoculated persons* | Serious AE/ADR reports | |
| From MAH | From medical institutes | |||
| Cervarix | 6,998,266 | 2,590,000 | 835 | 448 |
| Gardasil | 1,924,121 | 800,000 | 124 | 165 |
|
*Estimated from sales data
Note: AE: adverse event; ADR: adverse drug reaction; MAH: marketing Observation period: December 2009–February 2016 (Cervarix),August |
||||
Altre caratteristiche chiave delle ADR riportate con i vaccini HPV sono la diversità dei sintomi e il loro sviluppo “multi livello” e per un lungo periodo di tempo. Le ADR comprendono sintomi complessi e multi-sistema, come le convulsioni, disturbo della coscienza, dolori sistemici tra cui mal di testa, mialgia, artralgia, dolore alla schiena , disfunzione motoria come paralisi, debolezza muscolare, esaurimento e movimenti involontari, intorpidimento e disturbi sensoriali, sintomi tra cui vertigini, ipotensione, tachicardia, nausea, vomito e diarrea, disfunzione respiratoria tra cui dispnea e asma; disturbi endocrini, disturbi mestruali e ipermenorrea, ipersensibilità alla luce e al suono, sintomi psicologici come ansia, frustrazione, allucinazioni e eccesso della fame. La disfunzione cerebrale è più elevata come pure i disturbi cognitivi tra cui disturbi della memoria, disorientamento e perdita di concentrazione e disturbi del sonno tra cui ipersonnia e attacchi improvvisi. In alcuni casi, questi sintomi compromettono l’apprendimento e si traducono in estrema stanchezza e diminuzione della motivazione con un impatto negativo sulla vita quotidiana (8 , 9 , 10 , 11 ).
La situazione in Giappone è simile a quella in altri paesi che hanno anche segnalato un cluster specifico di sintomi gravi e complessi che si sviluppano su più sistemi corporei per un lungo periodo di tempo ( 12, 13 ).
La ragione per cui i vaccini HPV causano questi effetti avversi resta da studiare ma una delle spiegazioni più plausibili è che questi vaccini sono progettati per “mantenere un titolo anticorpale estremamente alto per un lungo periodo di tempo”. Poiché le reazioni infiammatorie prolungate associate all’infezione sono note per causare malattie autoimmuni ed un peggioramento delle reazioni autoimmuni ( 14 ), la stimolazione antigenica ripetuta nel tempo potrebbe anche indurre reazioni autoimmuni complesse attraverso un meccanismo simile a quello osservato con un’infezione prolungata.
Tutti i danneggiati hanno iniziato a divulgare la propria esperienza e ovviamente la stampa non lo ha riportato ma in risposta alla situazione il MHLW ha ritirato la sua raccomandazione nel giugno 2013 sulla base di “una relazione causale innegabile tra dolore persistente e vaccinazione” ( 1 ). Di conseguenza, i tassi di vaccinazione sono calòati mostruosamente: dall’80% a meno meno dell’1% al momento ( 15 )]. In risposta a questo cambiamento, i sostenitori del vaccino HPV hanno iniziato attivamente a fare pressioni sul governo.
Il 20 gennaio 2014, il comitato consultivo di esperti istituito dal MHLW ( 16 ) ha affermato che le reazioni avverse non siano dovute al vaccino ma da reazioni psicosomatiche dovute all’ansia o al dolore stimolatorio causato dall’iniezione dell’ ago, non erano a causa dei componenti del vaccino stesso. Tuttavia, i medici e i ricercatori che hanno esaminato i pazienti danneggiati e la loro conclusione è che non si tratta di reazioni psicosomatiche ma danni e anche gravi ( 9 , 10 , 11 ).
Pertanto, la sicurezza del vaccino HPV rimane tutt’altro che certa in Giappone, giustificando la forte sfiducia dei cittadini ed intanto le società farmaceutiche hanno avviato una strategia di risanamento (chiamiamola così) attraverso l’Organizzazione Mondiale della Sanità (OMS). Il comitato consultivo globale sulla sicurezza dei vaccini , ovvero il GACVS (uno dei comitati consultivi dell’OMS) ha affermato che “non ha riscontrato alcun problema di sicurezza che altererebbe o andrebbe a modificare le loro raccomandazioni per la vaccinazione” , criticando così la decisione del MHLW di ritirare invece la suddetta raccomandazione ( 17 ).
Nonostante questi ostacoli, nel luglio 2016, un gruppo di danneggiati ha intentato una causa multipla nella corte distrettuale di Tokyo, Nagoya, Osaka e Fukuoka contro il governo giapponese e le due società farmaceutiche che avevano prodotto questi vaccini. Inoltre, nel dicembre dello stesso anno, altre vittime si unirono alla causa, portando il numero totale di querelanti a 119 ( 18 ).
- Il problema con il vaccino HPV: confutare la dichiarazione GACVS ( 19 )
- Problemi di sicurezza
Indagine del MHLW
Per quanto riguarda il Giappone, la dichiarazione GACVS ( 17 ) afferma che “la revisione dei dati clinici da parte del comitato nazionale di esperti ha portato a concludere che i sintomi non erano correlati al vaccino”. Tuttavia, ci sono grossi problemi con l’indagine del comitato di esperti ( 16 ).
Il problema più serio è che pochissimi membri del comitato hanno effettivamente esaminato i pazienti con danni post-vaccinazione. L’indagine del comitato si è concentrata esclusivamente sul dolore e sulla disfunzione motoria, ignorando tutti gli altri sintomi osservati. Inoltre, i casi in cui gli eventi avversi si sono verificati a più di un mese dopo la vaccinazione, sono stati esclusi dalla considerazione in base al fatto che la maggior parte degli effetti avversi dei vaccini si verificano entro un mese dalla medesima. Tuttavia, studi successivi hanno chiarito che i sintomi compaiono comunemente anche dopo un considerevole periodo di tempo dalla vaccinazione ( 9 , 10 , 11 ).
Anche i metodi usati per determinare le reazioni psicosomatiche come causa dei sintomi pone qualche dubbio ( 16 ). Il comitato consultivo di esperti ha proposto quattro ipotesi riguardanti la fisiopatologia dei sintomi post-vaccinazione: (i) disturbo neurologico, (ii) intossicazione, (iii) reazione immunologica e (iv) reazione psicosomatica. Quei casi che non sono conformi ai criteri del comitato per (i) – (iii) sono stati considerati come non avere alcuna relazione causale con il vaccino HPV. Tuttavia, poiché la definizione della risposta psicosomatica è ambigua e la diagnosi è fatta esclusivamente dal giudizio soggettivo del medico, molti casi vengono diagnosticati come reazioni psicosomatiche.
Medici e ricercatori hanno sottolineato che è impossibile catalogare tutte le reazioni avverse come reazioni psicosomatiche sulla base dei risultati di esperimenti e case report ( 8 , 9 , 10 , 11 , 20 , 21 , 22 ). Prima di indagare sulla neuroimmunopatia associata al vaccino HPV (HANS), tratteremo un nuovo concetto di malattia proposto da Nishioka ( 22 ), Yokota et al.
Questi, hanno escluso dalla loro indagine tutti gli individui che presentavano anomalie fisiche / psicologiche prima della vaccinazione ( 9). Pertanto, il disegno del sondaggio ha ulteriormente rafforzato la conclusione che la risposta psicosomatica non poteva spiegare la maggior parte degli eventi avversi del vaccino HPV, come sostenuto dal comitato.
Inoltre, poiché 11 dei 15 membri del comitato consultivo di esperti hanno conflitti di interesse con i produttori di vaccini? Inoltre la popolazione è legittimata a richiedere che gli scienziati rivedano i dati pertinenti ( 23 ).
MA INTANTO..
Al di fuori del Giappone, Jefferson et al. ( 24 ) e Gõtzsche et al. ( 25 ) hanno espresso preoccupazione per la natura e la qualità della regolamentazione del vaccino HPV da parte dell’EMA.
La Critica delle prove di sicurezza citate nella dichiarazione GACVS
Per quanto riguarda la sicurezza del vaccino HPV, il GACVS ha affermato nella sua dichiarazione di non aver riscontrato alcun problema di sicurezza che giustificasse un’alterazione delle sue raccomandazioni per l’uso del vaccino e ha criticato il Giappone per aver interrotto la promozione attiva della vaccinazione HPV ( 17 ). Tuttavia, gli studi ( 26 , 27 , 28 , 29 , 30 , 31 ) citati dal GACVS come prova della sicurezza del vaccino sollevano le seguenti domande fondamentali.
- Base genetica di autoimmunità
Tra i meccanismi patofisiologici correlati alle reazioni avverse dopo la vaccinazione, il coinvolgimento dell’autoimmunità è uno dei più probabili. I vari meccanismi suggeriti per quanto riguarda le malattie autoimmuni includono: mimetismo molecolare ( 32 ), in cui un antigene estraneo condivide somiglianze strutturali con l’autoantigene; la distruzione dei meccanismi essenziali nella tolleranza immunitaria centrale e periferica ( 33 ); e i retrovirus endogeni umani che producono proteine funzionali o sviluppano anticorpi contro le proprie proteine individuali ( 34 ).
Sebbene l’eziologia non sia stata del tutto chiarita, la maggior parte delle malattie autoimmuni sono complesse condizioni poligeniche, in cui l’individuo affetto eredita molteplici polimorfismi genetici che contribuiscono alla suscettibilità della malattia e questi geni interagiscono con fattori ambientali per causare la malattia. È risaputo che alcuni alleli antigene leucocitario umano si verificano con maggiore frequenza nei pazienti con determinate malattie autoimmuni rispetto alla popolazione generale ( 35 , 36 ).
- Codifica e perdita di informazioni importanti
Nelle agenzie di regolamentazione dei farmaci e nell’industria farmaceutica, tutti gli eventi avversi nella cartella clinica di un paziente sono codificati ma i dettagli contenuti nei “dati grezzi” vengono “persi”. Di conseguenza, il significato clinico e l’entità del rischio di reazione sono mascherati ( 37 , 38 ). Questo processo si traduce nell’isolamento dei dati degli eventi avversi, analizzati non completamente.
- Cambiamento di paradigma
L’HPV è dotato di vari meccanismi di evasione immunitaria, che potrebbero indurre il S.I a diventare più tollerante all’infezione, creando un microambiente suscettibile di ulteriore infezione e facilitando la progressione della neoplasia intraepiteliale cervicale (CIN). Per contrastare questi meccanismi di evasione immunitaria, il vaccino HPV è progettato per mantenere un livello straordinariamente elevato di anticorpi per oltre un decennio ( 39 , 40 ). Ciò sposta il vaccino HPV fuori dal paradigma del “vaccino”, come viene convenzionalmente inteso. Queste caratteristiche uniche del vaccino HPV rendono essenziale condurre una valutazione più approfondita della sua sicurezza.
Efficacia
Mentre GACVS afferma che “l’impatto dei vaccini HPV sugli esiti clinici correlati all’HPV, incluse le lesioni pre-cancerose, è ben consolidato”, in realtà l’efficacia del vaccino HPV è piuttosto limitata, come discusso di seguito.
Innanzitutto, l’unico effetto verificato del vaccino HPV è preventivo sulle lesioni precancerose (in particolare CIN) ma l’effetto preventivo sul cancro del collo dell’utero non è stato stabilito. Gli effetti dei vaccini attualmente approvati in Giappone (Cervarix e Gardasil) su lesioni precancerose sono stati dimostrati solo nei casi di HPV 16 e 18, che, secondo gli studi più attendibili, rappresentano solo il 50% dei casi di cancro cervicale in Giappone ( 41 ).
Inoltre, il 10% di casi di infezione da HPV ad alto rischio si traducono in infezioni persistenti che possono causare il cancro, mentre la maggior parte delle lesioni pre-cancerose (CIN) sviluppano la risoluzione prima di diventare cancerose ( 42 , 43 ). Pertanto, solo lo 0,15% delle persone infette da HPV ad alto rischio sviluppa un cancro (invasivo) ( 44 , 45). Anche se il cancro si sviluppa, controlli regolari possono aiutare a rilevarlo in una fase precoce.
- Difetti strutturali: un punto di vista etico
Nelle sezioni precedenti, abbiamo discusso varie questioni riguardanti la sicurezza e l’efficacia del vaccino HPV. È ora opportuno chiedersi in che modo tali vaccini discutibili siano diventati di uso diffuso. La risposta, almeno per quanto riguarda il Giappone, può essere trovata in un difetto strutturale, combinato in particolare con i seguenti fattori: (i) promozione aggressiva dell’industria farmaceutica, (ii) negoziati commerciali da parte di superpoteri economici e (iii) medicina contemporanea , caratterizzata da un’eccessiva fiducia nella tecnologia ed una mancanza di umiltà rispetto all’ascolto dei reclami dei pazienti.
| Table 2: Vaccination and legal categorisation | ||
| Category | Responsibility of individual | Vaccination |
| Routine vaccination A | Duty to make effort to receive vaccination | Hib, pneumococcal, BCG, diphtheria, pertussis, tetanus, polio, measles, rubella, varicella, HPV, HB, Japanese Encephalitis |
| Routine vaccination B | No particular social duty | Influenza (for elderly), pneumococcal |
| Optional vaccination | Discretion of individual | Pneumococcal (for adults), rotavirus,etc. |
- Legge sull’immunizzazione e promozione del vaccino HPV da parte dei produttori
In seguito alla promulgazione della legge sull’immunizzazione in Giappone nel 1948, numerose azioni legali furono intentate in risposta ai danni correlati al vaccino. Ciò ha comportato l’istituzione di un sistema di compensazione per le vittime e la modifica delle leggi e dei regolamenti in materia. Attualmente, i vaccini sono divisi in tre categorie, come mostrato nella Tabella 2 ( 48 ).
Secondo le definizioni contenute nella legge, un vaccino per la protezione individuale, come il vaccino HPV, dovrebbe essere classificato come vaccinazione “facoltativa” che è esclusivamente una scelta individuale. Tuttavia, a causa delle attività di lobbismo, il vaccino HPV è stato approvato come vaccino da somministrare a spese pubbliche, incluso nella categoria “Vaccinazione di routine A”. Inoltre è stato raccomandato dal governo, per tanto le persone si sono sentite “obbligate” a vaccinarsi.
La commissione di esperti giapponesi per l’eliminazione del cancro cervicale ( 49 ) è stata fondata nel novembre 2008, nel periodo in cui il vaccino HPV veniva sottoposto a revisione per l’approvazione. I membri esecutivi di varie società accademiche mediche si unirono a questo gruppo ed esercitarono una notevole influenza sul processo legislativo, così come sulla pubblica amministrazione e sulla formazione dell’opinione pubblica.
Secondo le informazioni ottenute da Medwatcher Japan ( 50 ) nell’ambito della Linea guida per la relazione tra le attività aziendali e le istituzioni mediche ( 51 ) dell’Associazione dei produttori farmaceutici giapponesi, i fondi ricevuti dalla commissione di esperti dai produttori di vaccini ammontavano a ¥ 73.500.000 (¥ 35.000.000 nel 2012 e ¥ 38.500.000 nel 2013). Inoltre, è stato scoperto che il segretario del comitato lavorava presso la GlaxoSmithKline Co. come direttore marketing per i vaccini, fino a otto mesi prima del lancio di Cervarix. Questi fatti suggeriscono fortemente che l’attività della commissione di esperti non era altruistica, ma un realtà di CONFLITTO D’INTERESSE ( 52 ).
La promozione del vaccino HPV durante i negoziati commerciali tra Giappone e Stati Uniti ha anche creato pressione affinché SI UTILIZZASSE vaccino, inutile dirlo ( 53 , 54 55 , 56 ) .
Professionisti che dimenticano il loro ruolo
I difetti insiti nella comunità medica sono alla base del problema del vaccino HPV. Nel 2004, Sheldon Krimsky ha sottolineato la crescente influenza del mercantilismo nella scienza accademica e nella ricerca biomedica (lo si può leggere nel suo libro Science in the private interest 57 ).
Si utilizza la scienza per proteggere gli interessi dell’industria farmaceutica ed è utilizzata per negare la relazione causale tra il farmaco e le sue reazioni avverse. Molti ricercatori ed esperti stanno tentando di escludere considerazioni scomode.
“La tassonomia delle malattie rappresenta la scienza più vicina alla natura, ma rimane un costrutto teorico”( 58 , 59). Ciò significa che i medici devono essere più umili e scientificamente onesti. La diagnostica e la terapia odierne sono state create ascoltando i pazienti e conducendo esami accurati. È irresponsabile respingere la denuncia di un paziente come una reazione psicogena o un fenomeno generale senza condurre un esame approfondito.
- Considerazioni per risolvere i problemi
Come descritto nella sezione III, l’introduzione della vaccinazione contro l’HPV in Giappone è stata promossa ponendo l’accento sugli interessi commerciali piuttosto che sulla necessità di salute pubblica. Questa situazione non è unica per il Giappone ed è stata osservata anche in altri paesi. In Australia, ad esempio, nonostante i considerevoli dubbi del comitato consultivo sui benefici farmaceutici in merito al vaccino Gardasil, la decisione della commissione di respingere l’aggiunta di Gardasil al programma nazionale di vaccinazione è stata rapidamente annullata a seguito di interferenze politiche e pressioni esercitate da altri interessi acquisiti ( 60). Negli Stati Uniti, Merck & Co, Inc ha promosso l’imposizione della vaccinazione HPV per la frequenza scolastica , facendo pressione sui legislatori, redigendo leggi, mobilitando politici, organizzazioni di medici e conducendo campagne di marketing per i consumatori . I legislatori hanno fatto molto affidamento su Merck per tutte le informazioni scientifiche ( 61 ) dimenticando che la responsabilità di dimostrare l’efficacia e la sicurezza di un vaccino spetta alle società farmaceutiche ed il governo dovrebbe monitorare e guidare tali sforzi. La situazione attuale in cui gli interessi commerciali guidano la politica del governo deve essere corretta dal punto di vista dell’etica medica.
Allo stato attuale, il Giappone è uno dei pochi paesi in cui la raccomandazione attiva della vaccinazione contro l’HPV è stata temporaneamente interrotta; le autorità di regolamentazione di altri paesi non hanno cambiato le loro politiche. Sebbene vari gruppi di danneggiati abbiano collaborato ad attività di ampia portata in questi paesi, le autorità di regolamentazione non hanno ancora ammesso la relazione causale tra i vaccini e le lesioni alla salute delle vittime.
La decisione del governo giapponese di smettere di raccomandare attivamente la vaccinazione contro l’HPV ha, in una certa misura, incoraggiato i pazienti (e non solo) di altri paesi a mettere in discussione la vaccinazione contro l’HPV.
È necessario migliorare la trasparenza in ogni fase del processo di approvazione dei prodotti farmaceutici, dallo sviluppo di nuovi farmaci alla sorveglianza post-marketing. Allo stesso tempo, è fondamentale rafforzare la gestione dei conflitti di interesse e sviluppare un sistema attraverso il quale i cittadini possano partecipare direttamente ed avere voce in capitolo nella pianificazione della politica di sanità pubblica ( 63 , 64 , 65 ).
Conflict of interest
All the authors are members of Medwatcher Japan. Masumi Minaguchi and Masato Sekiguchi are Lawyers for the plaintiffs in the HPV vaccination lawsuits.
Riferimenti
DOI: https://doi.org/10.20529/IJME.2017.021
- Notification from MHLW on routine vaccination programme of HPV vaccine 2013.6.14 [Japanese] [cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/stf/shingi2/0000091963.html
- International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use. ICH Harmonised Tripartite guideline Clinical Safety Data Management: Definitions and Standards for Expedited Reporting E2A [cited 2017 Mar 25]. Available from: https://www.imim.es/media/upload/arxius/MEDIA436.pdf
- Documents 16&17 distributed at the meeting of Council of Health Sciences, subcommittee of vaccination, ADR Working group meeting, May 23, 2016 [ Japanese][cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/stf/shingi2/0000125164.html
- Documents distributed at the meeting of Council of Health Sciences, subcommittee of vaccination, ADR Working group meeting, April 12, 2016 [Japanese] [cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/stf/shingi2/0000121045.html
- Documents distributed at the meeting of Council of Health Sciences, subcommittee of vaccination, ADR Working group meeting, May 23, 2016 Japanese][cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/stf/shingi2/0000125164.html
- Lawrence G, Gold MS, Hill R, Deeks S, Glasswell A, McIntyre PB. Annual report: Surveillance of adverse events following immunisation in Australia, 2007. Commun Dis Intell Q Rep. 2008 Dec;32(4):371-87.
- National Vaccine Information Center. An Analysis by the National Vaccine Information Center of Gardasil & Menactra Adverse Event Reports to the Vaccine Adverse Events Reporting System (VAERS), February 2009[cited 2017 Mar 25]. Available from: http://www.cbsnews.com/htdocs/NVICGardasilvsMenactraVAERSReportFeb2009.pdf
- Kinoshita T, Abe RT, Hineno A, Tsunekawa K, Nakane S, Ikeda S. Peripheral sympathetic nerve dysfunction in adolescent Japanese girls following immunization with the human papillomavirus vaccine. Intern Med. 2014;53(19):2185-200.
- Yokota S, Kuroiwa Y, Nakamura I, Nakajima T, Nishioka K. General overview and discussion on HPV vaccine associated neuropathic syndrome. Japan Medical Journal (Nihon Iji Shimpou) 2015;4758:46-53 [Japanese].
- Hirai T, Kuroiwa Y, Hayashi T, Uchiyama M, Nakamura I, Yokota S, Nakajima T, Nishioka K, Iguchi Y. Adverse effects of human papilloma virus vaccination on central nervous system. The Autonomic Nervous System. 2016;53:49-64.
- Ikeda S. Neurological complications in HPV vaccination. Brain and Nerve 2015;67(7):835-43 [Japanese].
- Tomljenovic L, Shaw CA. Human papillomavirus (HPV) vaccine policy and evidence-based medicine: are they at odds? Ann Med. 2013 Mar;45(2):182-93. doi: 10.3109/07853890.2011.645353.
- Brinth L, Theibel AC, Pors K, Mehlsen J.Suspected side effects to the quadrivalent human papilloma vaccine. Dan Med J. 2015;62(4):A5064.
- Sfriso P, Ghirardello A, Botsios C, Tonon M, Zen M, Bassi N, Bassetto F, Doria A.Infections and autoimmunity: the multifaceted relationship. J Leukoc Biol. 2010 Mar;87(3):385-95. doi: 10.1189/jlb.0709517. Epub 2009 Dec 16.
- Immunization coverage rates in Japan [cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/topics/bcg/other/5.html
- Conference Minutes of Council of Health Sciences, subcommittee of vaccination, ADR Working group meeting, January 20, 2014 [Japanese] [cited 2017 Mar 25]. Available from: http://www.mhlw.go.jp/stf/shingi2/0000091998.html
- Global advisory committee on vaccine safety: statement on safety of HPV-vaccines, December 17, 2015 [cited 2017 Mar 25]. Available from: http://www.who.int/vaccine_safety/committee/GACVS_HPV_statement_17Dec2015.pdf?ua=1
- Plaintiffs Lawyers of HPV Vaccines Lawsuits [cited 2017 Mar 25]. Available from: https://www.hpv-yakugai.net/
- Medwatcher Japan. Submission of “Refutation of GACVS (Global Advisory Committee on Vaccine Safety) statement on Safety of HPV vaccine on December17, 2015”, November 2016 [cited 2017 Mar 25]. Available from: http://www.yakugai.gr.jp/en/topics/topic.php?id=930
- Takahata K, Takashima H. A proposal for a new neurological examination for discrimination of autoimmune encephalopathy and somatoform disorders. Neurological Therapeutics. 2016;33(1):9-18 [Japanese].
- Aratani S, Fujita H, Kuroiwa Y, Usui C, Yokota S, Nakamura I, Nishioka K, Nakajima T. Murine hypothalamic destruction with vascular cell apoptosis subsequent to combined administration of human papilloma virus vaccine and pertussis toxin. Sci Rep. 2016 Nov 11;6:36943. doi: 10.1038/srep36943.
- Nishioka K, Yokota S, Matsumoto Y. Clinical features and preliminary diagnostic criteria of human papillomavirus vaccination associated with neuroimmunopathic syndrome (HANS). Int J Rheum Dis 2014;17(suppl 2): 6-29.
- Medwatcher Japan: Submission of a “Request to reconsider the rules on conflict of interest (COI) for Ministry of Health, Labour and Welfare councils – In light of the COI issues with council members regarding HPV vaccines”, April 2014 [cited 2017 Mar 25]. Available from: http://www.yakugai.gr.jp/en/topics/topic.php?id=863
- Jefferson T, Jõrgensen L. Human papillomavirus vaccines, complex regional pain syndrome, postural orthostatic tachycardia syndrome, and autonomic dysfunction – a review of the regulatory evidence from the European Medicines Agency. Indian J Med Ethics 2017;2(1):30-37.
- Gõtzsche PC, Jõrgensen KJ, MD, Jefferson T, Auken M, Brinth L. Complaint to the European ombudsman over maladministration at the European Medicines Agency (EMA) in relation to the safety of the HPV vaccines, October 10, 2016, [cited 2017 Mar 25]. Available from: http://nordic.cochrane.org/sites/nordic.cochrane.org/files/public/uploads/ResearchHighlights/Complaint-to-ombudsman-over-EMA.pdf
- Agence nationale de sécurité du medicament et des produits de santé. Vaccins anti-HPV et risque de maladies autoimmunes: etude pharmacoépidémiologique [French]. [cited 2017 Mar 25]. Available from: http://ansm.sante.fr/content/download/80841/1023043/version/1/file/Ansm_gardasil-Hpv2_Rapport_September-2015.pdf
- Rasmussen TA, Jõrgensen MR, Bjerrum S, Jensen-Fangel S, Stõvring H, õstergaard L, Sõgaard OS.Use of population based background rates of disease to assess vaccine safety in childhood and mass immunisation in Denmark: nationwide population based cohort study. BMJ.2012 Sep 17;345:e5823. doi: 10.1136/bmj.e5823.
- Arnheim-Dahlström L, Pasternak B, Svanström H, Sparén P, Hviid A.Autoimmune, neurological, and venous thromboembolic adverse events after immunization of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden: cohort study. BMJ. 2013 Oct 9;347:f5906. doi: 10.1136/bmj.f5906.
- Callréus T, Svanström H, Nielsen NM, Poulsen S, Valentiner-Branth P, Hviid A.Human papillomavirus immunization of adolescent girls and anticipated reporting of immune-mediated adverse events. Vaccine. 2009 May 14;27(22):2954-8. doi: 10.1016/j.vaccine.2009.02.106. Epub 2009 Mar 13.
- Descamps D, Hardt K, Spiessens B, Izurieta P, Verstraeten T, Breuer T, Dubin G.Safety of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine for cervical cancer prevention: a pooled analysis of 11 clinical trials. Hum Vaccin. 2009;5(5):332-40.
- Chao C, Klein NP, Velicer CM, Sy LS, Slezak JM, Takhar H, Ackerson B, Cheetham TC, Hansen J, Deosaransingh K, Emery M, Liaw KL, Jacobsen SJ. Surveillance of autoimmune conditions following routine use of quadrivalent human papillomavirus vaccine. J Intern Med.2012;271(2):193-203.doi: 10.1111/j.1365-2796.2011.02467.x. Epub 2011 Nov 15.
- Cusick MF, Libbey JE, Fujinam RS. Molecular Mimicry as a Mechanism of Autoimmune Disease. Clin Rev Allergy Immunol. 2012;42(1):102-11.
- Marson A, Housley WJ,Hafler DA. Genetic basis of autoimmunity. J ClinInvest. 2015;125(6):2234-41.
- Volkman HE, Stetson DB. The enemy within: endogenous retroelements and autoimmune disease. Nat Immunol. 2014;15(5):415-22.
- Abbas AK, Lichtman AH, Pillai S. Immunologic tolerance and autoimmunity. In: Abbas AK, Lichtman AH, Pillai S (eds). Cellular and Molecular Immunology, 8th ed. Philadelphia: Elsevier Saunders; 2015, pp.315-337.
- Castiblanco J, Anaya JM. Genetics and vaccines in the era of personalized medicine. Curr Genomics. 2015 Feb;16(1):47-59. doi: 10.2174/1389202916666141223220551.
- Healy D. Doctoring the data. In: Pharmageddon. Berkeley and Los Angeles: Univ. of California Press; 2012,pp.96-128.
- Herxheimer A. Pharmacovigilance still neglects patients. The Informed Prescriber. 2014;29(5):75-9 [Japanese].
- Einstein MH, Takacs P, Chatterjee A, Sperling RS, Chakhtoura N, Blatter MM, Lalezari J, David MP, Lin L, Struyf F, Dubin G; HPV-010 Study Group.Comparison of long-term immunogenicity and safety of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine and HPV-6/11/16/18 vaccine in healthy women aged 18-45 years: end-of-study analysis of a Phase III randomized trial. Hum Vaccin Immunother.2014;10(12):3435-45. doi: 10.4161/hv.36121.
- Naud PS, Roteli-Martins CM, De Carvalho NS, Teixeira JC, de Borba PC, Sanchez N, Zahaf T, Catteau G, Geeraerts B, Descamps D.Sustained efficacy, immunogenicity, and safety of the HPV-16/18 AS04-adjuvanted vaccine: final analysis of a long-term follow-up study up to 9.4 years post-vaccination. HumVaccin Immunother. 2014;10(8):2147-62. doi: 10.4161/hv.29532.
- Asato T, Maehama T, Nagai Y, Kanazawa K, Uezato H, Kariya K. A large case–control study of cervical cancer risk associated with human papillomavirus infection in Japan, by nucleotide sequencing-based genotyping. J Infect Dis. 2004 May 15;189(10):1829-32. Epub 2004 Apr 26.
- Ho GY, Bierman R, Beardsley L, Chang CJ, Burk RD. Natural history of cervicovaginal papillomavirus infection in young women. N Engl J Med.1998 Feb 12;338(7):423-8.
- Woodman CB, Collins S, Winter H, Bailey A, Ellis J, Prior P, Yates M, Rollason TP, Young LS.Natural history of cervical human papillomavirus infection in young women: a longitudinal cohort study. Lancet. 2001;357(9271):1831-6.
- Kawana K,Yasugi T. Human papillomavirus and neoplastic disorder. Antibiotics & Chemotherapy. 2006;22(10):1521-8 [in Japanese].
- Department of vaccines and other biologicals. The current status of development of prophylactic vaccines against human papillomavirus infection. Report of a technical meeting, Geneva, February 16-18, 1999.
- Paavonen J, Naud P, Salmerón J, Wheeler CM, Chow SN, Apter D, Kitchener H, Castellsague X, Teixeira JC, Skinner SR, Hedrick J, Jaisamrarn U, Limson G, Garland S, Szarewski A, Romanowski B, Aoki FY, Schwarz TF, Poppe WA, Bosch FX, Jenkins D, Hardt K, Zahaf T, Descamps D, Struyf F, Lehtinen M, Dubin G; HPV PATRICIA Study Group. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet. 2009;374 (9686):301-14. doi: 10.1016/S0140-6736(09)61248-4. Epub 2009 Jul 6.
- Quinn M, Babb P, Jones J, Allen E.Effect of screening on incidence of and mortality from cancer of cervix in England: evaluation based on routinely collected statistics. BMJ. 1999;318(7188):904-8.
- Immunization Act [cited 2017 Mar 25]. Available from: http://www.japaneselawtranslation.go.jp/law/detail/?id=2778&vm=04&re=01
- The Japanese Expert Board for the Eradication of Cervical Cancer [cited 2017 Mar 25]. Available from: http://www.cczeropro.jp/
- Medwatcher Japan. Complaint against HPV vaccine manufacturers’ alleged violations of the JPMA Promotion Code for Prescription Drugs [Japanese] [cited 2017 Mar 25]. Available from: http://www.yakugai.gr.jp/en/topics/topic.php?id=890
- Transparency guideline for the relation between corporate activities and medical institutions, The Japan Pharmaceutical Manufacturers Association (JPMA) [cited 2017 Mar 25]. Available from: http://www.jpma.or.jp/english/policies_guidelines/transparency_guideline.html
- Complaint against HPV vaccine manufacturers’ alleged violations of the JPMA Promotion Code for Prescription Drugs[cited 2017 Mar 25]. Available from: http://www.yakugai.gr.jp/en/topics/topic.php?id=890
- Annual Reform Recommendations from the Government of the United States to the Government of Japan under the U.S.-Japan Regulatory Reform and Competition Policy Initiative October 15, 2008[cited 2017 Mar 25]. Available from: https://www.google.com/url?q=https://ustr.gov/sites/default/files/uploads/agreements/morocco/pdfs/EHI%2520USG%2520Agenda%2520Items%25202-11-11%2520FINAL.pdf&sa=U&ved=0ahUKEwio496zzdDSAhWKH5QKHa4BDFoQFggEMAA&client=internal-uds-cse&usg=AFQjCNEf8amvE_-1ixWyJPGZcjmHAyLGaQ
- United States-JAPAN. Economic Harmonization Initiative, February 2011 [cited 2017 Mar 25]. Available from: https://www.google.com/url?q=https://ustr.gov/sites/default/files/2008-2009-Regul
- Wilson R, Paterson P, Larson HJ. The HPV vaccination in Japan – issues and options. CSIS, May 2014[cited 2017 Mar 25]. Available from: https://csis-prod.s3.amazonaws.com/s3fs-public/legacy_files/files/publication/140514_Wilson_HPVVaccination_Web.pdf
- Wilson R, Paterson P, Chiu J, Schulz W, Larson H. HPV vaccination in Japan — the continuing debate and global impacts. CSIS, April 2015 [cited 2017 Mar 25]. Available from: https://csis-prod.s3.amazonaws.com/s3fs-public/legacy_files/files/publication/150422_Wilson_HPVVaccination2_Web.pdf
- Sheldon Krimsky. Science in the private interest: has the lure of profits corrupted biomedical research? Oxford: Rowman & Littlefield Publishers, Inc; 2003, p4.
- Heath I.Following the story:continuity of care in general practice. In: Greenhalgh T, Hurwitz B (eds). Narrative based medicine. London: BMJ Books; 1998, pp.86.
- Rudebeck CE. Humanism in medicine. Benevolence or realism? Scand J Prim Health Care. 1992 Sep;10(3):161-2.
- Hart E. The history of questionable fast-tracked global HPV vaccination [cited 2017 Mar 25]. Available from: https://elizabethhart.files.wordpress.com/2013/02/the-history-of-questionable-fast-trackedglobal-hpv-vaccination.pdf
- Mello MM,Abiola S, Colgrove J. Pharmaceutical companies’ role in state vaccination policymaking: the case of humanpapillomavirus vaccination. Am J Public Health. 2012 May;102(5):893-8. doi: 10.2105/AJPH.2011.300576. Epub 2012 Mar 15.
- Suzuki T, Minaguchi M, Sekiguchi M. Law and safety of drug. Eidell Institute; 2015,p.348 [Japanese].
- Chalmers I. What do I want from health research and researchers when I am a patient? BMJ. 1995;310(6990):1315-18.
- Doshi P, Dickersin K, Healy D, Vedula SS, Jefferson T. Restoring invisible and abandoned trials: a call for people to publish the findings. BMJ.2013 Jun 13;346:f2865. doi: 10.1136/bmj.f2865.
- Beppu H. Reasons why patients should take part in the planning of clinical trials. The Informed Prescriber 2010;25(4):45-9 [Japanese].
Vaccini Informa
Riproduzione consentita purché l'articolo non sia modificato in nessuna parte, indicando Autore e link attivo al sito.