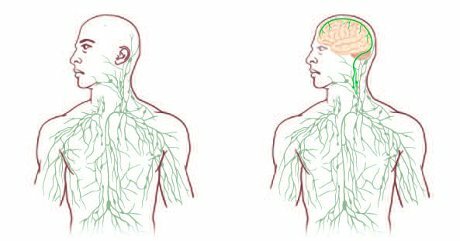
Autismo: caratteristiche strutturali e funzionali del sistema nervoso centrale e dei vasi linfatici
Nel giugno 2015 su le Scienze si parlava della scoperta della ramificata rete di sottili vasi linfatici che attraversa le meningi: la sua esistenza smentisce l’idea, radicata da oltre un secolo, che il cervello fosse completamente isolato dal sistema immunitario. La scoperta potrà avere notevoli ricadute sullo studio e la terapia di molte malattie neurologiche.
Anche il cervello ha un collegamento diretto con il sistema linfatico. A scoprirlo, smentendo la convinzione consolidata che il cervello sia isolato dal sistema linfatico (e quindi da quello immunitario), è stato un gruppo di ricercatori dell’Università della Virginia a Charlottesville, che firmano un articolo pubblicato su “Nature”. La scoperta potrebbe avere notevoli implicazioni per lo studio e la cura di varie malattie neurologiche, a partire dalla sclerosi multipla.
Un team di ricercatori,da tempo, studia accuratamente la tematica dell’ASD; una pandemia allo stato attuale ancora senza alcuna risposta.
Autismo: collegamento diretto tra sistema nervoso centrale e vasi linfatici. Importante osservare le disregolazioni immunologiche.
Il Disturbo dello spettro autistico (ASD) rappresenta una minaccia pandemica per lo sviluppo del bambino; con i dati attuali del CDC si stima che l’ASD colpisce oltre il 2% dei maschi americani in età scolare ( CDC Developmental Disabilities rete di monitoraggio di sorveglianza) .
L’ASD potrebbe essere e far parte di un gruppo eterogeneo di malattie aventi cause genetiche e ambientali derivanti in fenotipi simili.
La causa genetica nell’autismo può comportare la formazione di sinapsi e la maturazione (secondo uno studio condotto presso la Columbia University, il cervello di bambini autistici sarebbe ”sovrappopolato” da ‘sinapsi).
- Così, più geni coinvolti nella formazione delle suddette sinapsi sarebbero stati identificati come fattori di rischio per lo sviluppo dell’ASD (Hahn et al.,2013/ Lainhart 2015 ).
L’eziologia dell’ASD è ancora misteriosa, tuttavia i dati sulla neuroinfiammazione sono in crescita (Fatemi et al. 2012)e la recente pubblicazione in Nature dell’esistenza del sistema linfatico meningeo precedentemente sconosciuto, invita a valutare la questione ancor più da vicino (Louveau et al. 2015).
- Nel 1983, Aarli azzardò l’ipotesi che il fluido del cervello potesse viaggiare lungo misteriosi canali perivascolari, osservando che si potrebbe influenzare l’integrità della barriera emato-encefalica(Aarli 1983).
Siamo d’accordo con il seguente commento (Louveau et al, 2015.) : “La presenza di un sistema linfatico funzionale, nel sistema nervoso centrale, suggerisce una revisione dei dogmi vigenti in questa tematica”.
Di fondamentale importanza è osservare le disregolazione immunologiche nell’autismo, le quali si intersecano con le osservazioni di aumento CSF extra-assiale (EAF) nella popolazione dell’ASD.
Utilizzata la risonanza magnetica (Shen et al., 2013) per valutare l’EAF dei bambini nati in famiglie con la presenza di bimbi autistici.
Questa tecnica è stata in grado di predire la futura insorgenza e addirittura il livello di gravità di autismo sulla base dei risultati dei primi e persistenti aumenti delle EAF.
- In modo simile, siamo stati in grado di dimostrare una maggiore EAF utilizzando l’ecografia transcranica, osservando una correlazione tra l’aumento della gravità dei sintomi autistici e l’aumento degli EAF (Bradstreet et al., 2014).
I meccanismi responsabili di tale aumento EAF, tuttavia, sono ancora sconosciuti. Il sistema linfatico meningeo è una recente scoperta che potrebbe aiutare a spiegare come le disfunzioni immunologiche e periferiche (infezione / infiammazione cronica) possono influenzare le meningi e, di conseguenza, lo sviluppo del cervello.
Diverse evidenze indicano una connessione tra meningi e uno sviluppo anomalo del sistema nervoso centrale. Le cellule meningee sono coinvolte nello sviluppo corticale (Dragunow2013), e l’ alterazione meningea nei topi, contribuiscono alla neurogenesi non corretta durante lo sviluppo del cervello (Mercier et al., 2011).
- Nel 2012, Zarbalis et al. hanno dimostrato che i difetti cellulari meningei, alterano la migrazione degli interneuroni corticali, sottolineando ulteriormente il ruolo delle meningi nella creazione di adeguate interconnessioni neuronali(Zarbalis et al.,2012).
Le osservazioni di aumento EAF nella popolazione con autismo (tenendo presente le nuove osservazioni sul collegamento tra il sistema linfatico centrale ai linfonodi cervicali) dovrebbero prestare maggiore attenzione al ruolo dei linfatici meningea nella patogenesi di ASD. Si pone inoltre la domanda: “potrebbe l’infiammazione essere associata a dei deficit di linfodrenaggio meningea e di conseguenza essere la causa dell’aumento EAF?”
Osservando i dati, la nostra attenzione si concentra sul potenziale patogenetico delle infezioni croniche che portano all’infiammazione e conseguente deficit di drenaggio linfatico.
Sono state notate infezioni croniche / infiammazione in ASD patogenesi, come pure infezioni multiple polyomaviral,osservate e trovate nel cervello post-mortem di individui con ASD(Lintas et al.,2010) ; alterazioni immunitarie della corteccia temporale che sembrano indicare la disregolazione immunitaria con conseguente infiammazione (Garbett et al., 2008).
Piras et al. (2014) crede fermamente che l’infiammazione cronica sia un denominatore comune che può portare ad un aumento EAF a causa del ridotto drenaggio linfatico meningea.
L’esistenza di un sistema linfatico classico nel sistema nervoso centrale potrebbe anche spiegare la natura delle lesioni nel cervello dei soggetti autistici (Bradstreet et al., 2014).
Il drenaggio inefficiente con accumulo focale di PSC in alcune aree della corteccia, potrebbe spiegare la comparsa ipoecogena di “patch”, che abbiamo costantemente osservato nei soggetti autistici. L’accumulo di fluido che appare tipicamente ipoecogena in ecografia, potrebbe quindi interrompere la rete neuronale, aumentando la distanza tra le cellule e aumentando la pressione extracellulare su cellule con conseguente alterazione dell’espressione genica attraverso la modifica del citoscheletro (Knöll 2010).
Dal momento che Stoner et al. (2014) osservò anche “patch” di diminuzione della trascrizione nei campioni bancari del cervello con disturbo di ASD, si è tentati di ipotizzare che tali alterazioni dell’espressione genica possano essere associati all’accumulo di EAF e dei suoi effetti sulla funzione neuronale.
Infine, l’ecografia transcranica merita più attenzione come un mezzo di valutazione delle CSF. Questa,consente la valutazione riproducibile di EAF, misurando le distanze tra la membrana aracnoide e lo strato corticale pia (spazio subaracnoidea), potendo quindi contribuire a stabilire il grado di deficit di drenaggio linfatico meningea.
Poiché le misure possono essere facilmente ripetute, la tecnica potrebbe essere utilizzata per monitorare la progressione della malattia o per valutare oggettivamente l’efficacia dei trattamenti.
In conclusione, l’osservazione Louveau et al. (2015) ci porta ad ipotizzare che un deficit del drenaggio linfatico meningea a causa di infezione cronica periferica / infiammazione può essere responsabile di una maggiore EAF come pure si una displasia corticale nei soggetti ASD .
Gli autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretate come un potenziale conflitto di interessi.
CORRELATI
Microbioma: stimolazione del sistema immunitario. Autismo, AIDS, cancro.
Intervista al Dr Marco Ruggiero.
Il Prof. Marco Ruggiero e le nuove frontiere delle neuroscienze e dell’immunologia: dal cancro, all’autismo, all’AIDS.
La scoperta dei vasi linfatici cerebrali e del sistema immunitario attivo anche nel SNC e nuovi approcci terapeutici che aprono la strada a nuove e insperate possibilità di cura ed alla comprensione della vera eziopatogenesi di molte malattie neurologiche ed immunitarie.
Riferimenti
Aarli, J. A. (1983). The immune system and the nervous system. J. Neurol. 229, 137–154.
Bradstreet, J. J., Pacini, S., and Ruggiero, M. (2014). A new methodology of viewing extra-axial fluid and cortical abnormalities in children with autism via transcranial ultrasonography. Front. Hum. Neurosci. 7:934. doi: 10.3389/fnhum.2013.0093
[CDC] Developmental Disabilities Monitoring Network Surveillance Year 2010 Principal, Investigators; Centers for Disease, Control, Prevention. (2014). Prevalence of autism spectrum disorder among children aged 8 years – autism and developmental disabilities monitoring network, 11 sites, United States, 2010. MMWR Surveill. Summ. 63, 1–21.
Dragunow, M. (2013). Meningeal and choroid plexus cells – novel drug targets for CNS disorders.Brain Res. 1501, 32–55. doi: 10.1016/j.brainres.2013.01.013
Fatemi, S. H., Aldinger, K. A., Ashwood, P., Bauman, M. L., Blaha, C. D., Blatt, G. J., et al. (2012). Consensus paper: pathological role of the cerebellum in autism. Cerebellum 11, 777–807. doi: 10.1007/s12311-012-0355-9
Garbett, K., Ebert, P. J., Mitchell, A., Lintas, C., Manzi, B., Mirnics, K., et al. (2008). Immune transcriptome alterations in the temporal cortex of subjects with autism. Neurobiol. Dis. 30, 303–311. doi: 10.1016/j.nbd.2008.01.012
Hahn, N., Geurten, B., Gurvich, A., Piepenbrock, D., Kästner, A., Zanini, D., et al. (2013). Monogenic heritable autism gene neuroligin impacts Drosophila social behaviour. Behav. Brain Res. 252, 450–457. doi: 10.1016/j.bbr.2013.06.020
Knöll, B. (2010). Actin-mediated gene expression in neurons: the MRTF-SRF connection. Biol. Chem. 391, 591–597. doi: 10.1515/BC.2010.061
Lainhart, J. E. (2015). Brain imaging research in autism spectrum disorders: in search of neuropathology and health across the lifespan. Curr. Opin. Psychiatry 28, 76–82. doi: 10.1097/YCO.0000000000000130
Lintas, C., Altieri, L., Lombardi, F., Sacco, R., and Persico, A. M. (2010). Association of autism with polyomavirus infection in postmortem brains. J. Neurovirol. 16, 141–149. doi: 10.3109/13550281003685839
Louveau, A., Smirnov, I., Keyes, T. J., Eccles, J. D., Rouhani, S. J., Peske, J. D., et al. (2015). Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337–341. doi: 10.1038/nature14432
Mercier, F., Cho Kwon, Y., and Kodama, R. (2011). Meningeal/vascular alterations and loss of extracellular matrix in the neurogenic zone of adult BTBR T+ tf/J mice, animal model for autism.Neurosci. Lett. 498, 173–178. doi: 10.1016/j.neulet.2011.05.014
Piras, I. S., Haapanen, L., Napolioni, V., Sacco, R., Van de Water, J., and Persico, A. M. (2014). Anti-brain antibodies are associated with more severe cognitive and behavioral profiles in Italian children with Autism Spectrum Disorder. Brain Behav. Immun. 38, 91–99. doi: 10.1016/j.bbi.2013.12.020
Shen, M. D., Nordahl, C. W., Young, G. S., Wootton-Gorges, S. L., Lee, A., Liston, S. E., et al. (2013). Early brain enlargement and elevated extra-axial fluid in infants who develop autism spectrum disorder.Brain 136(Pt 9), 2825–2835. doi: 10.1093/brain/awt166