Farmaci Ritirati dal commercio e/o Oggetto di Monitoraggio
TERZA PARTE
DIVIETO DI SOMMINISTRAZIONE E RITIRO DEI FARMACI CONTENENTI CODEINA
L’Agenzia Italiana del Farmaco (AIFA), con provvedimento n. AIFA/PQ/N°81083/P del 29.07.2013….
ha disposto il divieto di somministrazione ai bambini sotto i 12 anni ed il conseguente ritiro entro 48h dei farmaci contenenti codeina, un potente antidolorifico, in quanto possono causare gravi problemi respiratori.
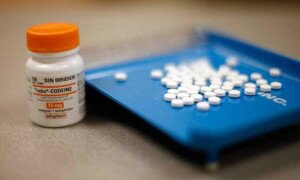
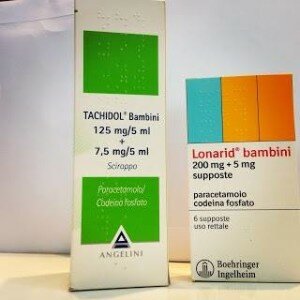
Tra questi i seguenti prodotti attualmente commercializzati: • TACHIDOL sciroppo, flacone da 120 ml (AIC 031825019) • LONARID bambini 200 mg + 5 mg, 6 supposte (AIC 020204119)
Ed i seguenti prodotti i quali, ancorché attualmente non commercializzati, risultano comunque registrati:
• TACHIDOL bambini bustine 125 mg/5 ml + 7,5 mg (AIC 031825033)
• PARACETAMOLO + CODEINA ANGENERICO 125 mg + 7,5 mg granulato effervescente 10 bustine (AIC 034370027)
• PARACETAMOLO + CODEINA ANGENERICO 2,5 g + 0,150 g sciroppo flacone da 120 ml (AIC 034370039)
I provvedimenti sono stati emanati a seguito del ricevimento della posizione finale dell’EMA sulla valutazione dei medicinali antidolorifici contenenti codeina dopo che l’organismo aveva stilato in data 01.07.2013 un primo comunicato focalizzando l’attenzione sugli effetti collaterali dei farmaci contenenti Codeina.
Secondo le conclusioni dell’EMA la rivalutazione del rapporto beneficio-rischio di tali medicinali porterebbero a considerare ancora favorevole il profilo beneficio-rischio nei bambini solo di età superiore ai 12 anni, mentre al di sotto di tale età la codeina non deve essere utilizzata come antidolorifico a causa del rischio di tossicità da oppioidi.
Tale rischio è aumentato nei bambini metabolizzatori ultra-rapidi della codeina e in pazienti pediatrici sottoposti ad rimozione chirurgica di tonsille e/o adenoidi. Il TACHIDOL è un analgesico-antipiretico utilizzato nel trattamento sintomatico del dolore da moderato a severo che non risponde al trattamento con analgesici non-oppioidi utilizzati da soli prodotto dalle Aziende Chimiche Riunite Angelini Francesco-A.C.R.A.F. S.p.A..
Tra le controindicazioni del farmaco vi sono: “ipersensibilità ai principi attivi o ad uno qualsiasi degli eccipienti; pazienti affetti da grave anemia emolitica; grave insufficienza epatocellulare e patologie epatiche in fase attiva; insufficienza respiratoria;
soggetti affetti da fenilchetonuria; gravidanza”.
Tra le speciali avvertenze e precauzioni per l’uso invece vengono riportate: “dosi elevate o prolungate del prodotto possono provocare un’epatopatia ad alto rischio e alterazioni, anche gravi, a carico del rene e del sangue (paracetamolo) o dipendenza (codeina);
nelle persone anziane l’uso prolungato degli alcaloidi dell’oppio può aggravare una preesistente patologia (cerebrale, vescicale, ecc.); somministrare con cautela nei soggetti con insufficienza renale (clearance della creatinina ≤ 30ml/min) o epatica.
In tali casi è consigliabile distanziare le dosi di almeno 8 ore; usare con cautela in caso di alcoolismo cronico, eccessiva assunzione di alcol (3 o più bevande alcoliche al giorno), anoressia, bulimia o cachessia, malnutrizione cronica (basse riserve di glutatione epatico), disidratazione, ipovolemia; durante il trattamento con paracetamolo prima di assumere qualsiasi altro farmaco controllare che non contenga lo stesso principio attivo, poiché se il paracetamolo è assunto in dosi elevate si possono verificare gravi reazioni avverse; in caso di reazioni allergiche si deve sospendere la somministrazione.
È opportuno, per la presenza di codeina, non assumere bevande alcoliche; la codeina può provocare aumento dell’ipertensione intracranica; nei pazienti che hanno subito l’asportazione della colecisti, la codeina può indurre dolore addominale biliare o pancreatico acuto, generalmente associato con anomalie nei test di laboratorio, indicative di spasmo dello sfintere di Oddi;
in presenza di tosse che produce catarro, la codeina può impedire l’espettorazione; usare con cautela nei soggetti con carenza di glucosio-6-fosfato deidrogenasi; invitare il paziente a contattare il medico prima di associare Tachidol a qualsiasi altro farmaco.
http://www.torrinomedica.it/farmaci/schedetecniche/Tachidol.asp#axzz2dvhhABEH
Il LONARID, prodotto da Boehringer Ingelheim Italia Spa, è usato nel trattamento di nevralgie, mialgie ed artralgie; mal di denti e dolori consecutivi ad estrazioni dentarie; cefalee di ogni tipo; otalgie; dismenorrea; dolori post-operatori e post-traumatici; stati dolorosi dei bambini. 
Naturalmente, chiunque stesse utilizzando i sopracitati prodotti in bambini con età inferiore ad anni 12 è invitato a sospenderne la somministrazione, a riportare i prodotti in farmacia ed a rivolgersi al proprio medico/pediatra di fiducia per modificare la prescrizione. Ricordiamo peraltro che, secondo quanto riferitoci da medici di fiducia, il farmaco più adatto al trattamento del dolore nei bambini resta il paracetamolo o, in alternativa e a discrezione del pediatra, l’ibuprofene stando sempre attenti ad utilizzarli nei modi, tempi e quantità consigliate.
http://www.torrinomedica.it/farmaci/schedetecniche/Lonarid.asp#axzz2dvhhABEH
Detto ciò, non ci possiamo esimere, come nostro uso, dall’effettuare le seguenti considerazioni:
1). Sempre più spesso assistiamo al ritiro o alla sospensione di medicinali di ogni tipo. Se da una parte alcuni tentano di avvalorare la tesi che ciò dipende da maggiori controlli e che quindi i cittadini debbono stare tranquilli, dall’altra abbiamo avuto modo di constatare nel corso degli anni di come tali provvedimenti avvengano sempre con notevole ritardo, spesso a distanza di anni dall’immissione in commercio, ed in seguito a segnalazioni provenienti o da Enti sovranazionali o dalle stesse case farmaceutiche, quasi mai dagli organismi nazionali che dovrebbero essere deputati a ciò.
2). I farmaci in questione infatti non sono certo di nuova produzione in quanto il Tachidol ha ricevuto la prima autorizzazione nel giugno 1997, successivamente rinnovata nel giugno 2010 mentre il Lonarid ha ricevuto la prima autorizzazione addirittura nel giugno 1990 ed il suo rinnovo nel maggio 2005.
Da ciò consegue che i dubbi da sempre sollevati in merito ai controlli preventivi rispetto all’autorizzazione in commercio dei farmaci non sono, evidentemente, così campati in aria se è vero che anche in questi casi ci sono voluti rispettivamente 16 e 23 anni prima di giungere a tali provvedimenti.
A nulla potrebbero valere le considerazioni relative ad eventuali nuove metodiche di controllo utilizzate – delle quali peraltro non è stato possibile rinvenire alcuna traccia né nel provvedimento dell’AIFA né in quello dell’EMA – né tantomeno nuovi studi su tali prodotti o sulla stessa Codeina in quanto non è dato conoscerne di così recenti da non aver potuto evitare i rinnovi rispettivamente del 2010 e del 2005.
3). Più volte abbiamo lamentato in passato come le istituzioni pubbliche (Ministero della Salute, ISS etc.) abbiano, se non formalmente, almeno di fatto abdicato al proprio ruolo di “controllo” rimettendo tali gravose incombenze alle stesse case farmaceutiche che, vale la pena ricordarlo, non sono certo enti filantropici ma società per azioni tenute a rispondere in termini di profitti e di ricavi ai propri azionisti. Così facendo le case farmaceutiche vanno ad unificare quei ruoli di “controllato” e “controllore” che dovrebbero invece essere tenuti ben distanti. A tal proposito, vale la pena ricordare quanto accaduto nell’autunno 2012 quando vennero ritirati dal commercio dapprima alcuni lotti di vaccino Infanrix Hexa in ben 21 Paesi (tranne che nel nostro!) e quindi un vaccino antinfluenzale.
In quest’ultima occasione il Ministro, nel corso della conferenza stampa tenuta a fine ottobre, dichiarò che la casa farmaceutica in questione (Novartis n.d.r.) era a conoscenza del problema dai primi di luglio ma che aveva informato il Ministero solo il giorno precedente! Nonostante tale gravissima negligenza, non risulta che il Ministero abbia preso alcun provvedimento nei confronti della casa farmaceutica in questione. Senza considerare poi le affermazioni grottesche in merito al presunto ritiro “preventivo” dei farmaci; forse sarebbe il caso di intenderci su cosa si intenda veramente per “preventivo” nella sua duplice accezione:
a). Preventivo nel senso di “prima che venga immesso in commercio”: personalmente ritengo che si possa parlare di ritiro “preventivo” solo durante la fare di realizzazione e produzione di un farmaco, al massimo fino a quando questo, magari già confezionato, sia ancora all’interno del luogo di produzione. Se un prodotto esce dal luogo di produzione e magari ha giù raggiunto da giorni o mesi ASL e farmacie non si potrà comunque parlare di ritiro “preventivo”.
b). Preventivo nel senso di “prima che possa arrecare danni”: ritengo che sia una mera forma di stile utilizzata dall’AIFA, dall’ISS e dagli altri organismi sovranazionali al solo scopo di “salvare il salvabile” ovvero di rendere quanto più “indolore” possibile il ritiro dal commercio di un farmaco. Se prendiamo il foglietto illustrativo o le caratteristiche di un farmaco qualsiasi troviamo una sequela di controindicazioni, effetti indesiderati, reazioni allergiche e similari che la casa farmaceutica ha riportato in base a segnalazioni e dati certi, non certo a caso; per questo motivo, soprattutto nel caso in cui le motivazioni siano collegate ad effetti già segnalati, ritengo non si possa parlare di ritiro “preventivo” .
4). La possibilità che tali farmaci potessero indurre problematiche epatiche e respiratorie era espressamente indicata nei rispettivi fogli illustrativi ma nonostante ciò nessuno si era mai posto evidentemente il problema degli effetti nei confronti dei bambini; perché?
5). Per il momento il provvedimento riguarda solo il divieto di somministrazione dei farmaci ai minori di 12 anni ma, alla luce di quanto accaduto in questi anni anche in merito ad altri farmaci, possiamo essere assolutamente certi che questi prodotti possano essere somministrati tranquillamente ai maggiori di anni 12? Chi ci può garantire che l’organismo di un bambino di 12 anni risponda effettivamente meglio rispetto a quello di un bambino di 11 anni e mezzo? In base alle considerazioni sopra espresse, ritengo ci sia poco da stare allegri e che sia sempre più attuale il vecchio detto che: “a pensar male si fa peccato ma spesso ci si prende”.
SOMMINISTRAZIONE DI FARMACI A BASE DI CODEINA
La Codeina è un farmaco oppiaceo che nell’organismo si trasforma in morfina, la sostanza che deve esercitare l’effetto antidolorifico.
Alcune persone metabolizzano rapidamente la codeina per cui i livelli di morfina presenti nel sangue raggiungono in fretta un livello piuttosto elevato per cui aumenta il rischio di effetti tossici, tra cui le difficoltà respiratorie.
Nella fattispecie, i problemi respiratori pare si siano verificati soprattutto nei bambini che soffrivano di apnea notturna e avevano subito un’operazione chirurgica di asportazione delle tonsille o delle adenoidi.
Tra i soggetti sotto i 12 anni per i quali, secondo l’AIFA, è controindicato l’uso della Codeina si segnalano: •Ragazzi sotto i 18 anni con problemi della funzionalità respiratoria • Ragazzi sotto i 18 anni dopo interventi di rimozione delle tonsille e/o delle adenoidi • Donne che allattano (la codeina può passare al neonato attraverso il latte materno) • Persone che hanno già avuto problemi seri con l’utilizzo della codeina In ogni caso, i farmaci che la contengono devono essere somministrati nelle dosi più basse consentite.
IL SERVIZIO DI FARMACOVIGILANZA..

MOLTISSIME SONO LE REAZIONI E I DANNI SUBITI DALL’USO DI FARMACI COME QUELLI SOPRA CITATI… QUI RIPORTATO DI SEGUITO UN LINK CHE RIPORTA LE MOLTISSIME REAZIONI GRAVI E I VARI FARMACI RITIRATI DAL COMMERCIO E/O SOTTO MONITORAGGIO…
http://www.farmacovigilanza.org/search/search.aspx?querytype=FreeText&search=bibliografia
Roaccutan: il farmaco dagli effetti collaterali shock
E’ utilizzato per curare l’acne, ma provoca anche “suicidio e depressione”
05/05/2014
Si chiama Roaccutan ed è un medicinale della Roche che serve a curare l’acne, ma in Gran Bretagna è finito sotto accusa perchè sembrerebbe indurre alla depressione e al suicidio.
Tutto è iniziato nel 2012, quando un ragazzo di 26 anni, Jamie Sillcock, si tolse la vita dopo aver utilizzato il Roaccutan, per curare la sua acne, per diversi anni.
I genitori del ragazzo, il 25 aprile scorso, hanno addirittura organizzato una manifestazione di protesta, fuori dalla sede della Roche.
Il caso è finito sulla scrivania della Commission on Human Medicines, che sta studiando i possibili effetti collaterali del farmaco.
“Gli effetti collaterali del farmaco affliggono una certa percentuale di pazienti che lo assumono e in che modo vengono causati i danni – commenta il padre di Jamie Sillcock sul Daily Mail – E’ come una roulette russa, nessuno sa quali possano essere i danni per ognuna delle persone che lo assumono. La compagnia farmaceutica ha fatturato milioni con il Roaccutan, ma ha devastato migliaia di famiglie.
Siamo felici che ora il governo britannico abbia deciso di fare chiarezza. Se tante famiglie come noi non avessero fatto pressione oggi non sarebbe accaduto e per noi è una piccola vittoria”.
“Il Roaccutan ha migliorato la vita di molte persone che soffrono di acne, ma come ogni farmaco può avere degli effetti collaterali – replica un portavoce della Roche – Ad oggi non sono state definite relazioni di causa-effetto per sbalzi di umore e depressione legate all’assunzione del farmaco nei pazienti con acne, a parte in rari casi documentati. In via precauzionale raccomandiamo a chiunque abbia manifestato questo o altri possibili effetti collaterali del farmaco di rivolgersi immediatamente al proprio medico”.
FONTE RIPORTATA DI SEGUITO
http://www.lafucina.it/2014/05/05/roaccutan-il-farmaco-dagli-effetti-collaterali-shock/
REAZIONI CUTANEE GRAVI DA ISOTRETINOINA…
Reazioni cutanee gravi da isotretinoina.
L’Agenzia Regolatoria dei Medicamenti e dei Prodotti per la Salute inglese (MHRA) dichiara che L’isotretinoina è un farmaco usato per il trattamento dell’acne severa resistente ad adeguati cicli di antibiotici o terapia topica.
In associazione all’uso di questo farmaco, sono stati riportati casi di eritema multiforme (EM) sindrome di Stevens-Johnson (SJS) e necrolisi epidermica tossica (TEN)
Isotretinoina è un farmaco da prescrizione potenzialmente pericoloso che può essere assunto solo sotto stretta supervisione di un medico o di un farmacista.
Durante la gravidanza, può indurre difetti congeniti, aborto, parto
http://www.farmacovigilanza.org\servizi\csm-mca\0704-14.asp (3087 bytes)
e per saperne di più…
http://www.farmacovigilanza.org\servizi\csm-mca\1101-05.asp (3018 bytes)
.L’isotretinoina provoca infarto del miocardio.
Riferito da Prescrire International 2007;
Dal report del ministero della salute Canadese, pubblicato nell’aprile del 2006, sugli eventi cardiovascolari in pazienti in terapia con isotretinoina orale risulta che, tra il 1983 ed il 2005, sono stati registrati 29 casi di disturbi cardiovascolari.
Isotretinoina e disturbi psichiatrici
Nel 2007, l’agenzia regolatoria francese per i farmaci (Afssaps) ha segnalato “15 casi di suicidio e 20 di tentato suicidio” in pazienti in trattamento orale con l’antiacne isotretinoina.
L’Agenzia ha ricevuto queste segnalazioni tra il 1985 ed il 2007…
tutto reperibile qui… http://www.farmacovigilanza.org\servizi\lc848.asp
per maggiori info ,qui..
http://www.farmacovigilanza.org\servizi\lc685.asp (2612 bytes)
Riproduzione consentita purché l'articolo non sia modificato in nessuna parte, indicando Autore e link attivo al sito.







There are no comments at the moment, do you want to add one?
Scrivi un commento